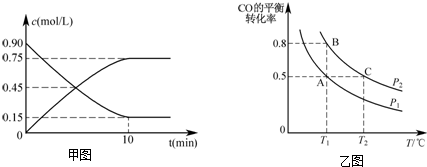
题目内容
15.为了提纯下列物质(括号内为杂质),所选用的除杂试剂、分离方法、必用仪器均正确的是( )| 选项 | 不纯物质(杂质) | 除杂试剂或分离方法 | 必用仪器 |
| A | 碘水 | 四氯化碳 萃取 | 分液漏斗 |
| B | 一氧化碳(二氧化碳) | 澄清石灰水 洗气 | 洗气瓶 |
| C | 硝酸钾(氯化钠) | 直接蒸发结晶 | 蒸发皿 |
| D | 乙醇(水) | 生石灰 蒸馏 | 蒸馏烧瓶 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碘不易溶于水,易溶于四氯化碳;
B.石灰水的浓度小,吸收二氧化碳效果不好;
C.二者均溶于水,但溶解度受温度影响不同;
D.CaO与水反应后,增大与乙醇的沸点差异.
解答 解:A.碘不易溶于水,易溶于四氯化碳,则利用分液漏斗分液可分离,故A正确;
B.石灰水的浓度小,吸收二氧化碳效果不好,应选NaOH溶液、洗气,故B错误;
C.二者均溶于水,但溶解度受温度影响不同,则不能直接蒸发结晶,应冷却结晶分离,故C错误;
D.CaO与水反应后,增大与乙醇的沸点差异,则选蒸馏烧瓶蒸馏可分离,故D正确;
故选AD.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
3.为测定镁铝合金样品中铝的含量,进行下列实验:取一定量合金,加入100mL0.3mol•L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560mL;再加入0.2mol•L-1NaOH溶液至沉淀质量恰好不再变化,用去400mL NaOH溶液.则所取样品中铝的物质的量为( )
| A. | 0.005 mol | B. | 0.03 mol | C. | 0.02 mol | D. | 0.01 mol |
10.下列反应的离子方程式正确的是( )
| A. | 氢氧化钠溶液中通入少量二氧化硫:SO2+OH-=HSO3- | |
| B. | 氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O | |
| C. | 盐酸滴入氨水中:H++OH-=H2O | |
| D. | 碳酸钙溶解于稀硝酸中:CO32-+2H+=CO2↑+H2O |
2.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气.已知:
N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是 …( )
N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是 …( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ•mol-1 | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ•mol-1 | |
| C. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1 076.7 kJ•mol-1 | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 076.7 kJ•mol-1 |
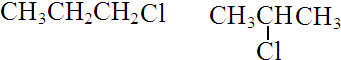 .
. 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.

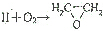 是原子利用率为100%的转化,Ⅱ的结构简式为CH2=CH2,
是原子利用率为100%的转化,Ⅱ的结构简式为CH2=CH2, 在一定条件下发生聚合反应生成聚酰胺类高分子化合物,写出该反应的化学方程式
在一定条件下发生聚合反应生成聚酰胺类高分子化合物,写出该反应的化学方程式 .
. )利用本题的信息,设计合成方案,用流程图表示并注明反应条件.例如,由乙醇合成聚乙烯的反应流程图可表示为:
)利用本题的信息,设计合成方案,用流程图表示并注明反应条件.例如,由乙醇合成聚乙烯的反应流程图可表示为: ,则反应的流程图为
,则反应的流程图为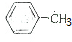 $→_{光照}^{氯气}$
$→_{光照}^{氯气}$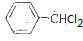 $→_{△}^{氢氧化钠溶液}$
$→_{△}^{氢氧化钠溶液}$ $\stackrel{HCN}{→}$
$\stackrel{HCN}{→}$ 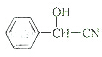 $→_{H_{2}O}^{H+}$
$→_{H_{2}O}^{H+}$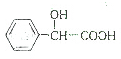 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$