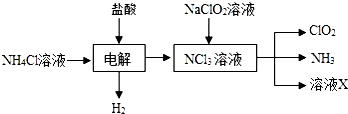
题目内容
3.为测定镁铝合金样品中铝的含量,进行下列实验:取一定量合金,加入100mL0.3mol•L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560mL;再加入0.2mol•L-1NaOH溶液至沉淀质量恰好不再变化,用去400mL NaOH溶液.则所取样品中铝的物质的量为( )| A. | 0.005 mol | B. | 0.03 mol | C. | 0.02 mol | D. | 0.01 mol |
分析 镁铝合金与硫酸反应生成硫酸镁、硫酸铝与氢气,向反应后的溶液中加入0.2 mol•L-1 NaOH溶液至沉淀质量恰好不再变化,铝离子转化为偏铝酸根、镁离子转化为氢氧化镁沉淀,此时溶液中溶质为Na2SO4、NaAlO2,根据硫酸根守恒有n(Na2SO4)=n(H2SO4),根据钠离子守恒有n(NaOH)=2n(Na2SO4)+n(NaAlO2),据此计算n(NaAlO2),再根据铝原子守恒n(Al)=n(NaAlO2).
解答 解:镁铝合金与硫酸反应生成硫酸镁、硫酸铝与氢气,向反应后的溶液中加入0.2 mol•L-1 NaOH溶液至沉淀质量恰好不再变化,铝离子转化为偏铝酸根、镁离子转化为氢氧化镁沉淀,此时溶液中溶质为Na2SO4、NaAlO2,根据硫酸根守恒有n(Na2SO4)=n(H2SO4)=0.1L×0.3mol/L=0.03mol,
根据钠离子守恒有:n(NaOH)=2n(Na2SO4)+n(NaAlO2),故n(NaAlO2)=0.4L×0.2mol/L-0.03mol×2=0.02mol,根据铝原子守恒:n(Al)=n(NaAlO2)=0.02mol,
故选C.
点评 本题考查混合物的有关计算,题目难度中等,明确发生的反应原理、利用守恒进行计算是解题关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
11.在一容积可变的密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(g)+4H2(g),下列有关叙述正确的是( )
| A. | 增加Fe的量,正反应速率增大 | |
| B. | 将容器的体积缩小一半,正逆反应速率增大 | |
| C. | 保持体积不变,充入Ne,正逆反应速率增大 | |
| D. | 保持压强不变,充入Ne,正逆反应速率不变 |
8.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,5.6 L H2O含有的分子数为0.25NA | |
| B. | 标准状况下,22.4 L H2和Cl2的混合气体中含有的分子数为2NA | |
| C. | 标准状况下,22.4 L SO3含有的原子个数为3NA | |
| D. | 常温常压下,58.5 g NaCl中含有的Na+离子数为NA |
15.为了提纯下列物质(括号内为杂质),所选用的除杂试剂、分离方法、必用仪器均正确的是( )
| 选项 | 不纯物质(杂质) | 除杂试剂或分离方法 | 必用仪器 |
| A | 碘水 | 四氯化碳 萃取 | 分液漏斗 |
| B | 一氧化碳(二氧化碳) | 澄清石灰水 洗气 | 洗气瓶 |
| C | 硝酸钾(氯化钠) | 直接蒸发结晶 | 蒸发皿 |
| D | 乙醇(水) | 生石灰 蒸馏 | 蒸馏烧瓶 |
| A. | A | B. | B | C. | C | D. | D |
11.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 32gO2和32gO3所含分子数目都为NA | |
| B. | 标准状况下,11.2 L水中含有的原子数是1.5NA | |
| C. | 0.1mol Fe参与化学反应转移的电子数一定为0.3NA | |
| D. | 标准状况下,5.6L氯气和16.8L氧气混合气体中含有的分子数为NA |