题目内容
【题目】某同学用下图装置电解硫酸钾溶液来获得氧气、氢气、硫酸和氢氧化钾。
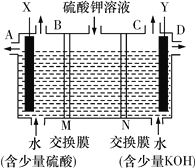
(1)X极与电源的________(填“正”或“负”)极相连,氢气从________(填“A”“B”“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”,下同)交换膜,N为________交换膜,图中少量硫酸和少量氢氧化钾的作用是________________________________________。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为______________________________________________。
(4)若使用铅蓄电池作电源完成上述电解,当制得11.2 L标准状况下的氢气时,理论上铅蓄电池消耗硫酸________ mol,正极板质量增加______g,负极板质量增加________g。
【答案】 正 C 阴离子 阳离子 增强溶液导电性 H2-2e-+2OH-===2H2O 1 32 48
【解析】目的是用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾,由装置图可知,硫酸应在左室得到,KOH在右室得到,左室为阳极室,氢氧根离子放电生成氧气,M为阴离子交换膜,硫酸根离子通过阴离子交换膜进入左室,右室为阴极室,氢离子放电生成氢气,N为阳离子交换膜,钾离子通过阳离子交换膜进入右室。则
(1)左室为阳极室,X极与电源正极相连,右室为阴极室,氢离子放电生成氢气,氢气从C口导出。(2)由上述分析可知,M为阴离子交换膜,N为阳离子交换膜。硫酸与氢氧化钾均是强电解质,图中少量硫酸和少量氢氧化钾的作用是增强溶液导电性;(3)将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:H2-2e-+2OH-=2H2O;(4)生成氢气物质的量为11.2L÷22.4L/mol=0.5mol,转移电子为0.5mol×2=1mol。铅蓄电池的总反应为Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l),所以理论上铅蓄电池消耗硫酸1mol,正极板发生反应:PbO2(s)+2e-+4H+(aq)+SO42-aq)=PbSO4(s)+H2O(l),所以正极板质量增加0.5mol×303g/mol-0.5mol×239g/mol=32g,负极板反应为Pb(s)-2e-+SO42-(aq)=PbSO4(s),质量增加0.5mol×96g/mol=48g。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案【题目】下列关于纯净物、混合物、强电解质、弱电解质和非电解质的组合正确的是
组合 | 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
A | 氨水 | 食盐水 | 硫酸 | 醋酸 | 干冰 |
B | 氧化铁 | 家用食醋 | 硫酸钡 | 碳酸 | 蔗糖 |
C | 胆矾 | 碘酒 | 苛性钠 | 碳酸 | 碳酸钙 |
D | 盐酸 | 氯化钾溶液 | 氯化钠 | 氢氧化铜 | 氢气 |
A.AB.BC.CD.D
【题目】(1)已知NO2和N2O4可以相互转化N2O4 (g)![]() 2NO2 (g)△H=+57.2kJ/mol。t℃时,现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下表所示,据此回答相关问题:
2NO2 (g)△H=+57.2kJ/mol。t℃时,现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下表所示,据此回答相关问题:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(x)/mol·L-1 | 0.2 | C | 0.6 | 0.6 | 1.2 | C1 | C1 |
c(Y)/mol·L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | C2 | C2 |
①前10 min内用N2O4表示的化学反应速率v(N2O4)=__________,t℃时,该反应的化学平衡常数K=__________。
②20min时,若只改变了某一个条件,该条件可能是__________。
③t℃时,若开始时向容器中充入1mol的NO2、0.2mol N2O4,则v(正)________v(逆)(填“>”“<”或“=”)
(2)一定压强下,向10L密闭容器中充入1molS2Cl2和1molCl2,发生反应S2Cl2(g) + Cl2(g)![]() 2SCl2(g)。Cl2和SCl2的消耗速率(v)与温度(T)的关系如图所示:
2SCl2(g)。Cl2和SCl2的消耗速率(v)与温度(T)的关系如图所示:
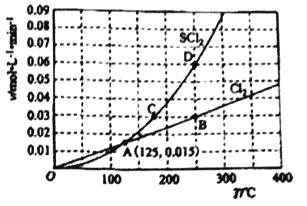
①ABCD四点对应状态下,达到平衡状态的有__________。
②△H2_______0(填“>”“<”或“=”)