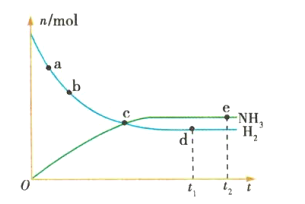
题目内容
【题目】下列实验过程中曲线变化正确的是( )
A. 表示Na2CO3溶液中滴入稀盐酸
表示Na2CO3溶液中滴入稀盐酸
B. 表示溴水中滴入Na2SO3溶液
表示溴水中滴入Na2SO3溶液
C. 表示AgNO3溶液中滴入氨水
表示AgNO3溶液中滴入氨水
D. 表示一定条件下2SO2+O22SO3达平衡后,升高温度
表示一定条件下2SO2+O22SO3达平衡后,升高温度
【答案】B
【解析】
A、碳酸钠和少量的盐酸之间反应生成氯化钠和碳酸氢钠,开始不会产生气体,故A错误;
B、溴单质具有氧化性,溴水中滴入![]() 溶液,溴水中的溴单质能将亚硫酸钠氧化为硫酸钠,并且会生成强酸HBr,所以酸性增强;随着
溶液,溴水中的溴单质能将亚硫酸钠氧化为硫酸钠,并且会生成强酸HBr,所以酸性增强;随着![]() 溶液的滴入,当氧化性的溴单质消耗掉,到最后相当于将之稀释,酸性减弱,pH增大,故B正确;
溶液的滴入,当氧化性的溴单质消耗掉,到最后相当于将之稀释,酸性减弱,pH增大,故B正确;
C、硝酸银中加入少量氨水,生成氢氧化银白色沉淀,继续滴加,沉淀消失,得到银氨溶液,故C错误;
D、![]() 是放热的,升高温度,化学反应速率加快,平衡逆向移动,即逆反应速率大于正反应速率,故D错误;
是放热的,升高温度,化学反应速率加快,平衡逆向移动,即逆反应速率大于正反应速率,故D错误;
故选:B。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】实验室常用亚硫酸钠固体和70%的浓硫酸制备SO2气体,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,请设计一套实验装置,收集一试管干燥的SO2气体。
(1)在下面方框中,A表示由分液漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必画出,尾气处理部分必须画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其它可选用的仪器(数量不限)简易表示如下:___
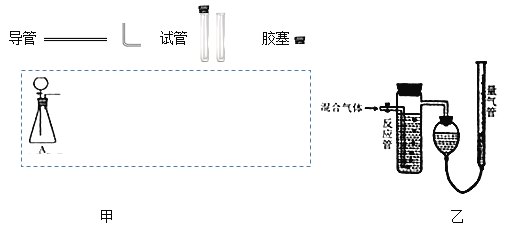
(2)根据方框中的装置图甲,在答题卡上填写下表(可不填满)___
仪器标号 | 仪器中所加物质 | 作用 |
A | 亚硫酸钠、浓硫酸 | 产生SO2 |
(3)某实验小组用如图乙装置测定收集到的气体中SO2的含量,反应管中装有酸性高猛酸钾溶液。
①SO2和酸性高猛酸钾溶液发生反应的离子方程式为:___。
②反应管内溶液紫红色消失后,若没有及时停止通气,则测得的SO2含量___(选填:“偏高”、“偏低”或“无影响”)
③若酸性高猛酸钾溶液体积为V1mL,浓度为cmol/L,量气管内增加的水的体积为V2mL(已折算成标准状况下的体积)。用c、V1、V2表示SO2的体积百分含量为___。
【题目】第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物,单质铁、砷及它们的化合物广泛应用于超导体材料等领域,请回答下列问题:
(1)Fe2+的核外电子排布式为_________________。
(2)NH3是一种很好的配体,NH3的沸点______(填“>”“=”或“<”)AsH3。
(3)N原子核外有______种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为___________。
(4)科学家通过X射线测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力为________________。

(5)As的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是________________。
(6)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________。

(7)FeS2晶体的晶胞如图所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_________g·cm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为_________nm。