题目内容
5.下列物质制备的方程式不正确的是( )| A. | 实验室制氯气:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 实验室制二氧化硫:Cu+SO42-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H20 | |
| C. | 实验室用浓氨水与生石灰制氨气:NH3•H20═Ca(OH)2+NH3↑ | |
| D. | 实验室制二氧化氮:Cu+4H++2NO3-═Cu2++2NO2↑+2H20 |
分析 A.加热条件下,实验室用浓盐酸和二氧化锰制取氯气,该离子方程式原子守恒、电荷守恒;
B.在实验室常用亚硫酸钠跟浓硫酸起反应制取二氧化硫,也可用铜和浓硫酸制取二氧化硫;
C.实验室用浓氨水与生石灰制氨气,是利用CaO与H2O剧烈反应,放出大量热,生成碱,促进NH3•H2O的逆向电离以及分解及NH3的挥发逸出;
D.铜和浓硝酸反应生成硝酸铜、二氧化氮和水,实验室用该原理制取二氧化氮.
解答 解:A.加热条件下,实验室用浓盐酸和二氧化锰制取氯气,二者反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故A正确;
B.铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,反应的方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,离子反应为:Cu+SO42-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H20,故B正确;
C.CaO与H2O剧烈反应,生成Ca(OH)2,放出大量热,促进NH3•H2O的分解及NH3的挥发逸出,生成Ca(OH)2是强碱,NH3+H2O?NH3•H2O?NH4++OH-,促进NH3•H2O的逆向电离,反应的化学方程式为:NH3•H2O+CaO═NH3↑+Ca(OH)2,故C错误;
D.反应生成硝酸铜、二氧化氮和水,离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故D正确;
故选C.
点评 本题考查了方程式书写方法和原理分析,掌握物质性质,分析判断 反应产物、注意离子方程式原子守恒、电荷守恒是解题关键,题目较简单.

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案| A. | 氮气分子的结构式:N-N | B. | Mg2+的结构示意图: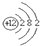 | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | 二氧化碳电子: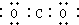 |
| A. | 10 L 0.05mol•L-1Ba(OH)2溶液与10 L 0.05mol•L-1 H2SO4反应时的反应热是中和热 | |
| B. | 由2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1知,该反应的反应热为571.6 kJ•mol-1 | |
| C. | 由2H2(l)+O2(l)=2H2O(g)△H=-482.6 kJ•mol-1知,H2的燃烧热为482.6 kJ•mol-1 | |
| D. | 由C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5 kJ•mol-1知,气体C3H8的燃烧热为2221.5 kJ•mol-1 |
| A. | K+、Cu2+、SO32-、MnO4- | B. | NH4+、Fe2+、NO3-、H+ | ||
| C. | HCO3-、Na+、Mg2+、Cl- | D. | Na+、K+、SO42-、Cl- |
| 元素 | 有关信息 |
| X | 所在主族序数与所在周期序数之差为4,在该周期中原子半径最小 |
| Y | 在最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| Z | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
| W | 地壳中含量最高的金属元素 |
| A. | W与Y的最高价氧化物对应的水化物之间可相互反应 | |
| B. | 原子半径的大小顺序为:rX>rY>rW | |
| C. | 向浓ZX3溶液中滴加少量的Na2SO3溶液,可产生大量沉淀和气体 | |
| D. | 可用电解W与X形成的化合物来制取W单质 |
| A. | 在50mL量筒中配制0.1000mol•L-1碳酸钠溶液 | |
| B. | 仅用烧杯、量筒、玻璃棒就可以配制100mL0.1000mol•L-1K2Cr2O7溶液 | |
| C. | 用100mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管和pH=1的盐酸配制100mLpH=2的盐酸 | |
| D. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余液体吸出 |
| A. | 铝片与稀盐酸的反应 | B. | 氢氧化钡晶体与氯化铵晶体的反应 | ||
| C. | 甲烷在氧气中的燃烧反应 | D. | 灼热的碳与二氧化碳的反应 |
