题目内容
【题目】某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
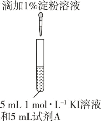
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0°C | 0.5 molL1稀硫酸 | 4 min 左右出现蓝色 |
② | 20°C | 1 min 左右出现蓝色 | ||
③ | 20°C | 0.1 molL1稀硫酸 | 15 min 左右出现蓝色 | |
④ | 20°C | 蒸馏水 | 30 min 左右出现蓝色 |
(1)为探究温度对反应速率的影响,实验②中试剂 A 应为______________。
(2)写出实验③中 I-反应的离子方程式:_____________________。
(3)对比实验②③④,可以得出的结论:_______________________。
(继续探究)溶液 pH 对反应速率的影响查阅资料:
i.pH<11.7 时,I-能被O2 氧化为 I2。
ii.pH= 9.28 时,I2发生歧化反应:3I2 +6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快。
(4)小组同学用 4 支试管在装有 O2 的储气瓶中进行实验,装置如图所示。
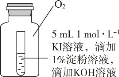
序号 | ⑤ | ⑥ | ⑦ | ⑧ |
试管中溶液的 pH | 8 | 9 | 10 | 11 |
放置 10 小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
分析⑦和⑧中颜色无明显变化的原因_______。
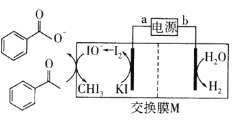
(5)甲同学利用原电池原理设计实验证实 pH=10 的条件下确实可以发生 I-被 O2 氧化为 I2 的反应,如图所示,请你填写试剂和实验现象。
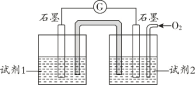
试剂1______________。 试剂2______________。实验现象:___________________________。
(深入探究)较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
序号 | 温度 | 试剂 | 现象 |
⑨敞口试管 | 水浴 70°C | 5 mL 1 molL1 KI 溶液 5 mL 0.5 molL1 稀硫酸 | 20 min 内仍保持无色,冷却至室温后滴加淀粉溶液出现蓝色 |
⑩密闭试管 | 溶液迅速出现黄色,且黄色逐渐加深,冷却至室温后滴加淀粉溶液出现蓝色 |
(6)对比实验⑨和⑩的现象差异,该小组同学对实验⑨中的现象提出两种假设,请你补充假设 1。
假设 1:_______________。
假设 2:45°C 以上 I2 易升华,70°C 水浴时,c(I2)太小难以显现黄色。
(7)针对假设 2 有两种不同观点。你若认为假设 2 成立,请推测试管⑨中“冷却至室温后滴加淀粉出现蓝色”的可能原因_______________(写出一条)。你若认为假设 2 不成立,请设计实验方案证明_______________。
【答案】0.5 molL1稀硫酸 4I- + O2 + 4H+ =2I2 + 2H2O 温度相同时,KI 溶液被 O2 氧化成 I2,c(H+)越大,氧化反应速率越快 试管⑦、⑧中,pH 为 10、11 时,既发生氧化反应又发生歧化反应,因为歧化速率大于氧化速率和淀粉变色速率,所以观察颜色无明显变化 试剂 1:1 mol·L1 KI 溶液,滴加 1%淀粉溶液 试剂 2:pH=10 的 KOH 溶液 现象:电流表指针偏转,左侧电极附近溶液变蓝(t<30 min) 加热使 O2 逸出,c(O2)降低,导致 I-氧化为 I2 的速率变慢 理由:KI 溶液过量(即使加热时有 I2 升华也未用光 KI),实验⑨冷却室温后过量的 KI 仍可与空气继续反应生成 I2,所以滴加淀粉溶液还可以看到蓝色 [其他理由合理给分,如淀粉与 I2 反应非常灵敏(少量的 I2 即可以与淀粉显色),所以实验⑨中少量的 I2 冷却至室温后滴加淀粉溶液还可以看到蓝色]。 水浴加热 70℃时,用湿润的淀粉试纸放在试管⑨的管口,若不变蓝,则证明假设 2 不成立[其他方案合理给分,如水浴加热 70℃时,用湿润的淀粉试纸放在盛有碘水试管的管口,若不变蓝,则证明假设 2 不成立]。
【解析】
某研究小组对碘化钾溶液在空气中发生4I- + O2 + 4H+ =2I2 + 2H2O的氧化反应,根据实验进行对比,探究反应温度和稀硫酸浓度对反应速率的影响,pH= 9.28 时,I2发生歧化反应:3I2 +6OH- = IO3-+5I-+3H2O,pH越大,歧化速率越快,整个反应主要是既发生氧化反应又发生歧化反应,根据歧化速率与氧化速率和淀粉变色速率快慢得出颜色变化;将反应设计成原电池,利用化合价升高和化合价降低来分析;在较高温度对反应速率的实验对比中,假设可能加热使 O2 逸出,c(O2)降低,导致 I-氧化为 I2 的速率变慢,也可能是45℃ 以上I2 易升华,70℃ 水浴时,c(I2)太小难以显现黄色。
(1)根据①、②为探究温度对反应速率的影响,其他条件不变,实验②中试剂A应为0.5 molL1稀硫酸;故答案为:0.5 molL1稀硫酸。
(2)实验③中I-与氧气在酸性条件下反应生成单质碘,其离子方程式4I- + O2 + 4H+ =2I2 + 2H2O;故答案为:4I- + O2 + 4H+ =2I2 + 2H2O。
(3)对比实验②③④,三者温度相同,稀硫酸浓度越大,反应速率越快,因此可以得出的结论:温度相同时,KI溶液被O2 氧化成I2,c(H+)越大,氧化反应速率越快;故答案为:温度相同时,KI溶液被O2 氧化成I2,c(H+)越大,氧化反应速率越快。
(4)根据题中信息及⑦和⑧中颜色无明显变化,说明试管⑦、⑧中,pH为10、11时,既发生氧化反应又发生歧化反应,因为歧化速率大于氧化速率和淀粉变色速率,所以观察颜色无明显变化;故答案为:试管⑦、⑧中,pH 为 10、11 时,既发生氧化反应又发生歧化反应,因为歧化速率大于氧化速率和淀粉变色速率,所以观察颜色无明显变化。
(5)根据离子反应方程式4I- + O2 + 4H+ =2I2 + 2H2O和图中信息氧气的通入,因此试剂 1为1 molL1 KI 溶液,滴加 1%淀粉溶液,试剂 2为pH=10的KOH溶液,因此可以看见实验现象电流表指针偏转,左侧电极附近溶液变蓝(t<30 min);故答案为:试剂 1:1 molL1 KI 溶液,滴加 1%淀粉溶液;试剂 2:pH=10 的 KOH 溶液;现象:电流表指针偏转,左侧电极附近溶液变蓝(t<30 min)。
(6)假设 1:加热使 O2 逸出,c(O2)降低,导致 I-氧化为 I2 的速率变慢;故答案为:加热使 O2 逸出,c(O2)降低,导致 I-氧化为 I2 的速率变慢。
假设 2:45℃ 以上 I2 易升华,70℃ 水浴时,c(I2)太小难以显现黄色。
(7)针对假设2有两种不同观点。你若认为假设 2 成立,请推测试管⑨中“冷却至室温后滴加淀粉出现蓝色”的可能原因KI 溶液过量(即使加热时有I2 升华也未用光KI),实验⑨冷却室温后过量的 KI 仍可与空气继续反应生成 I2,所滴加淀粉溶液还可以看到蓝色 [其他理由合理给分,如淀粉与 I2 反应非常灵敏(少量的 I2 即可以与淀粉显色),所以实验⑨中少量的 I2 冷却至室温后滴加淀粉溶液还可以看到蓝色]。你若认为假设2不成立,设计实验方案是水浴加热70℃时,用湿润的淀粉试纸放在试管⑨的管口,若不变蓝,则证明假设 2 不成立[其他方案合理给分,如水浴加热 70℃时,用湿润的淀粉试纸放在盛有碘水试管的管口,若不变蓝,则证明假设 2 不成立]。