题目内容
【题目】反应:3A(g)+B(g) = 2C(g) +2D(g),在不同条件下,用不同物质表示其反应速率,分别为:
①v(A)=0.6 mol/(L·min) ②v(B)=0.45 mol/(L·min)
③v(C)=0.015 mol/(L·min) ④v(D)=0.45 mol/(L·min)
则此反应在不同条件下进行最快的是( )
A.①B.②C.③D.④
【答案】B
【解析】
同一个化学反应用不同的物质表示其反应速率时,其数值可能是不同的,但表示的意义是相同的,所以比较反应速率大小时,不能直接比较速率数值大小,而是要先换算成用同一种物质来表示,然后才能直接比较速率数值大小。
根据速率之比是相应的化学计量数之比,如果都用物质A表示速率,则:
A选项v(A)=0.6 mol/(L·min);
B选项v(A)=3v(B)= 1.35mol/(L· min);
C选项v(A)=![]() v(C)= 0.0225mol/(L· min);
v(C)= 0.0225mol/(L· min);
D选项v(A)=![]() v(D)= 0.675mol/(L· min),
v(D)= 0.675mol/(L· min),
B选项速率最大,故选B。

【题目】能源与材料、信息一起被称为现代社会发展的三大支柱。面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的两个主要方向。
(1)化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一。某学生为了探究锌与盐酸反应过程中的速率变化,在400 mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:______ min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②另一学生为控制反应速率防止反应过快难以测量氢气体积。他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量。你认为可行的是______ (填字母序号)。
A.KCl溶液 B.浓盐酸 C.蒸馏水 D.CuSO4溶液
(2)如图为原电池装置示意图。
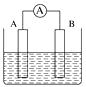
①将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_______(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入浓硝酸溶液中形成的原电池的正极反应式:_______。
②若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为2FeCl3+Cu=2FeCl2+CuCl2。写出B电极反应式:______;该电池在工作时,A电极的质量将______(填“增加”、“减小”或“不变”)。
【题目】某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0°C | 0.5 molL1稀硫酸 | 4 min 左右出现蓝色 |
② | 20°C | 1 min 左右出现蓝色 | ||
③ | 20°C | 0.1 molL1稀硫酸 | 15 min 左右出现蓝色 | |
④ | 20°C | 蒸馏水 | 30 min 左右出现蓝色 |
(1)为探究温度对反应速率的影响,实验②中试剂 A 应为______________。
(2)写出实验③中 I-反应的离子方程式:_____________________。
(3)对比实验②③④,可以得出的结论:_______________________。
(继续探究)溶液 pH 对反应速率的影响查阅资料:
i.pH<11.7 时,I-能被O2 氧化为 I2。
ii.pH= 9.28 时,I2发生歧化反应:3I2 +6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快。
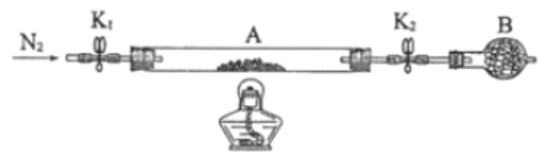
(4)小组同学用 4 支试管在装有 O2 的储气瓶中进行实验,装置如图所示。
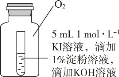
序号 | ⑤ | ⑥ | ⑦ | ⑧ |
试管中溶液的 pH | 8 | 9 | 10 | 11 |
放置 10 小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
分析⑦和⑧中颜色无明显变化的原因_______。
(5)甲同学利用原电池原理设计实验证实 pH=10 的条件下确实可以发生 I-被 O2 氧化为 I2 的反应,如图所示,请你填写试剂和实验现象。
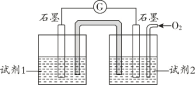
试剂1______________。 试剂2______________。实验现象:___________________________。
(深入探究)较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
序号 | 温度 | 试剂 | 现象 |
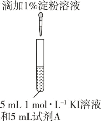
⑨敞口试管 | 水浴 70°C | 5 mL 1 molL1 KI 溶液 5 mL 0.5 molL1 稀硫酸 | 20 min 内仍保持无色,冷却至室温后滴加淀粉溶液出现蓝色 |
⑩密闭试管 | 溶液迅速出现黄色,且黄色逐渐加深,冷却至室温后滴加淀粉溶液出现蓝色 |
(6)对比实验⑨和⑩的现象差异,该小组同学对实验⑨中的现象提出两种假设,请你补充假设 1。
假设 1:_______________。
假设 2:45°C 以上 I2 易升华,70°C 水浴时,c(I2)太小难以显现黄色。
(7)针对假设 2 有两种不同观点。你若认为假设 2 成立,请推测试管⑨中“冷却至室温后滴加淀粉出现蓝色”的可能原因_______________(写出一条)。你若认为假设 2 不成立,请设计实验方案证明_______________。
【题目】下列实验方案设计中,无法达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 除去NaCl固体中少量的KNO3杂质 | 将固定溶于水配成溶液,蒸发结晶并趁热过滤 |
B | 检验乙酸乙酯中是否含有乙酸 | 加入含有酚酞的NaOH溶液并振荡,观察下层溶液颜色变化 |
C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化 |
D | 比较Fe3+和I2的氧化性强弱 | 向含有淀粉的KI溶液中滴入FeCl3溶液,观察溶液颜色变化 |
A.AB.BC.CD.D