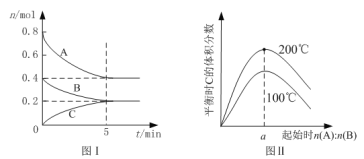��Ŀ����
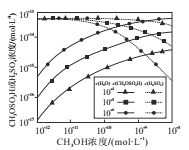
����Ŀ��ij�¶��£���2L���ݵ��ܱ�������X��Y��Z��������(��Ϊ��̬)����з�Ӧ�������ʵ�����ʱ��ı仯������ͼ����ͼ�ش�
(1)�÷�Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪ_______________________________________________��
(2)��Ӧ��ʼ��t min(��t��5)��X��ƽ����Ӧ������________________��
(3)��t minʱ���÷�Ӧ�ﵽ��____________״̬�����п��жϷ�Ӧ�Ѵﵽ��״̬����________(����ĸ����ͬ)��
A.X��Y��Z�ķ�Ӧ������� B.X��Y�ķ�Ӧ���ʱ�Ϊ2��3
C.���������ܶȲ��� D.����1molZ��ͬʱ����2molX
(4)�ӿ�ʼ��t��ĩX��ת����__________��
(5)��һ����ʹ�÷�Ӧ�ķ�Ӧ��������Ĵ�ʩ��________��
A.�����������䣬��ʱ��������� B.�ʵ������¶�
C.�����������䣬����X��Ũ�� D.����������䣬����Ar��ʹ������ѹǿ����
(6)��һ������̶����ܱ������У����еĿ��淴ӦA(s)+3B(g) ![]() 3C (g)�����������б������淴Ӧһ���ﵽƽ��״̬���� __________
3C (g)�����������б������淴Ӧһ���ﵽƽ��״̬���� __________
��C������������C�ķֽ�������ȣ�
�ڵ�λʱ��������a mol A,ͬʱ����3a mol B��
��B��Ũ�Ȳ��ٱ仯��
�ܻ�������ܵ����ʵ������ٷ����仯��
��A��B��C�����ʵ���֮��Ϊ1��3��3��
���������ܶȲ��ٱ仯��
���𰸡�2X(g)![]() 3Y(g)��Z(g) 0.08mol��L-1��min-1 ��ѧƽ�� D 33.3% C �٢ۢ�
3Y(g)��Z(g) 0.08mol��L-1��min-1 ��ѧƽ�� D 33.3% C �٢ۢ�
��������
����ͼʾ�з�Ӧ��ļ��������������������ȷ����ѧ����ʽ���������������и���ֵ����ʻ�Ũ���Ƿ����仯�жϷ�Ӧ�Ƿ�ﵽƽ��״̬������Ӱ�컯ѧ��Ӧ���ʵ������жϻ�ѧ��Ӧ���ʵı仯���ݴ˷�����
(1) ��ͼ����Կ�����X�����ʵ�����С����XΪ��Ӧ�Y��Z�����ʵ��������࣬��ΪY��ZΪ���������Ӧ����t minʱ��n(X)=0.8mol��n (Y)=1.2mol��n(Z)=0.4mol����ѧ��Ӧ�У������ʵ����ʵ����ı仯ֵ�뻯ѧ�����������ȣ�n(X)��n (Y)��n(Z)=2��3��1�������Է�Ӧ�Ļ�ѧ����ʽΪ��2X(g)![]() 3Y(g)��Z(g)��
3Y(g)��Z(g)��
(2)ij���ʵĻ�ѧ��Ӧ���ʵ������ʱ����Ũ�ȵı仯�������ʱ��ı�ֵ����X��ƽ����Ӧ����v=![]() =
= =0.08mol��L-1��min-1��
=0.08mol��L-1��min-1��
(3) t minʱ��ϵ�и����ʵ����ʵ������ٷ����仯��˵����Ӧ�Ѿ��ﵽ�˻�ѧƽ��״̬��
Aѡ�������ڸ����ʵĻ�ѧ���������ȣ���X��Y��Z�ķ�Ӧ������Ȳ���˵���Ƿ�ﵽƽ��״̬����A����
Bѡ�������ڻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ���û����ȷ���ʵ��������ʻ��Ƿ�Ӧ���ʣ���XΪ��������YΪ��������ʱ�����Ƿ�ﵽƽ��״̬��X��Y�ķ�Ӧ���ʱȶ�Ϊ2��3����B����
Cѡ�������ڷ�Ӧ�����������ܱ������н��У���Ӧ�����������������䣬�������䣬����������ܶȲ��䣬�����ж��Ƿ�ﵽƽ��״̬����C����
Dѡ��������1mol Z��ͬʱ����2mol X��˵�����淴Ӧ������ȣ��ﵽƽ��״̬����D��ȷ��
��ѡD��
(4)ת���ʵ������ʱ���ڷ�Ӧ�������ʵ����ʵ��������ʵ������ʵ����ı�ֵ��������X��ת����=![]() =33.3%��
=33.3%��
(5)Aѡ������������䣬��ʱ�����������ڷ�Ӧ���Ũ�Ȳ������仯���ʲ�������Ӧ���ʣ�A����
Bѡ��ʵ������¶ȣ�ʹ��λ����ڻ���Ӱٷ������ͣ����ͷ�Ӧ���ʣ�B����
Cѡ�����X��Ũ�ȿ�������λ�����X�Ļ���Ӱٷ���������Ӧ���ʣ�C��ȷ��
Dѡ�����������Ar������λ����ڻ���Ӱٷ������䣬��Ӧ���ʲ��䣬D����
��ѡ��C��
(6)��ͬһ���ʵķֽ�����������������ͬ��˵�����淴Ӧ������ͬ������˵����Ӧ��ƽ��״̬������ȷ��
�ڻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ������Ƿ�ﵽƽ��״̬�������ڵ�λʱ������a mol A��ͬʱ����3a mol B���ڴ���
�۷�Ӧ��ƽ��ʱ�����Ũ�Ȳ��ٷ����仯������˵������ƽ��״̬������ȷ��
�����巴Ӧ��������������Ļ�ѧ������֮����ȣ������Ƿ�ﵽƽ��״̬����������ܵ����ʵ��������䣬�ܴ���
��ƽ��ʱ�����ʵ����ʵ���ȡ������ʼ���ϱ��Լ�ת���ij̶ȣ���������ʵ����ıȲ�����Ϊ�ж��Ƿ�ﵽƽ��״̬�����ݣ��ݴ���
��AΪ���壬���������ܶȲ��仯��˵����������������䣬��Ӧ�ﵽƽ��״̬������ȷ��
��ѡ��٢ۢޡ�

 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д�����Ŀ��ij�о�С��Ե⻯����Һ�ڿ����з���������Ӧ�����ʽ���ʵ��̽����
������̽����
ʾ��ͼ | ��� | �¶� | �Լ�A | ���� |
| �� | 0��C | 0.5 molL1ϡ���� | 4 min ���ҳ�����ɫ |
�� | 20��C | 1 min ���ҳ�����ɫ | ||
�� | 20��C | 0.1 molL1ϡ���� | 15 min ���ҳ�����ɫ | |
�� | 20��C | ����ˮ | 30 min ���ҳ�����ɫ |
��1��Ϊ̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죬ʵ������Լ� A ӦΪ______________��
��2��д��ʵ����� I-��Ӧ�����ӷ���ʽ��_____________________��
��3���Ա�ʵ��ڢۢܣ����Եó��Ľ��ۣ�_______________________��
������̽������Һ pH �Է�Ӧ���ʵ�Ӱ��������ϣ�
i.pH��11.7 ʱ��I-�ܱ�O2 ����Ϊ I2��
ii.pH= 9.28 ʱ��I2�����绯��Ӧ��3I2 +6OH-=IO3-+5I-+3H2O��pHԽ���绯����Խ�졣
��4��С��ͬѧ�� 4 ֧�Թ���װ�� O2 �Ĵ���ƿ�н���ʵ�飬װ����ͼ��ʾ��
��� | �� | �� | �� | �� |
�Թ�����Һ�� pH | 8 | 9 | 10 | 11 |
���� 10 Сʱ������� | ������ɫ | ��ɫ�����Ա仯 | ||
�����ߺ͢�����ɫ�����Ա仯��ԭ��_______��
��5����ͬѧ����ԭ���ԭ�����ʵ��֤ʵ pH=10 ��������ȷʵ���Է��� I-�� O2 ����Ϊ I2 �ķ�Ӧ����ͼ��ʾ��������д�Լ���ʵ������
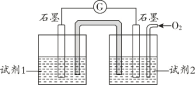
�Լ�1______________�� �Լ�2______________��ʵ������___________________________��
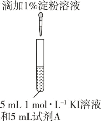
������̽�����ϸ��¶ȶԷ�Ӧ���ʵ�Ӱ��
С��ͬѧ�ֱ��ڳ����Թܺ��ܱ��Թ��н�����ʵ���͢⡣
��� | �¶� | �Լ� | ���� |
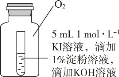
�᳨���Թ� | ˮԡ 70��C | 5 mL 1 molL1 KI ��Һ 5 mL 0.5 molL1 ϡ���� | 20 min ���Ա�����ɫ����ȴ�����º�μӵ�����Һ������ɫ |
���ܱ��Թ� | ��ҺѸ�ٳ��ֻ�ɫ���һ�ɫ�����ȴ�����º�μӵ�����Һ������ɫ |
��6���Ա�ʵ���͢��������죬��С��ͬѧ��ʵ����е�����������ּ��裬���㲹����� 1��
���� 1��_______________��
���� 2��45��C ���� I2 ��������70��C ˮԡʱ��c��I2��̫С�������ֻ�ɫ��
��7����Լ��� 2 �����ֲ�ͬ�۵㡣������Ϊ���� 2 ���������Ʋ��Թܢ��С���ȴ�����º�μӵ��۳�����ɫ���Ŀ���ԭ��_______________��д��һ������������Ϊ���� 2 �������������ʵ�鷽��֤��_______________��