题目内容
(8分)100ml 6mol/L的稀硝酸与1.92 g铜反应,铜完全溶解。求
(1)生成的气体在标况下为多少L?
(2)溶液中H+、NO3-的物质的量浓度?(设反应前后溶液的体积不变)
(1)生成的气体在标况下为多少L?
(2)溶液中H+、NO3-的物质的量浓度?(设反应前后溶液的体积不变)
硝酸的物质的量是0.1L×6mol/mol=0.6mol
铜是1.92g÷64g/mol=0.03mol
根据反应式可知
3Cu + 8HNO3=3Cu(NO3)2+2NO↑+4H2O
3mol 8ml 2×22.4L
0.03mol 0.08 0.448L
即硝酸是过量的,所以生成NO是0.448L
参加反应的硝酸是0.08mol
被还原的硝酸是0.02mol
所以溶液中H+、NO3-的物质的量浓度分别是 、
、
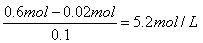
铜是1.92g÷64g/mol=0.03mol
根据反应式可知
3Cu + 8HNO3=3Cu(NO3)2+2NO↑+4H2O
3mol 8ml 2×22.4L
0.03mol 0.08 0.448L
即硝酸是过量的,所以生成NO是0.448L
参加反应的硝酸是0.08mol
被还原的硝酸是0.02mol
所以溶液中H+、NO3-的物质的量浓度分别是
 、
、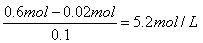
考查根据化学方程式进行的有关计算。

练习册系列答案
相关题目