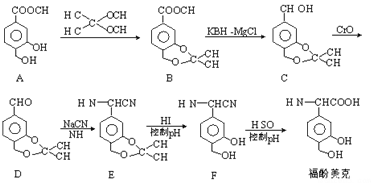
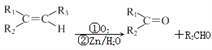
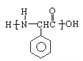
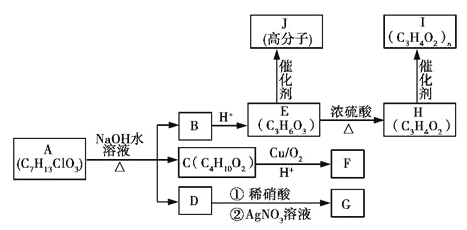
题目内容
【题目】2016年冬季全国大部分地区出现雾霾现象,汽车尾气是造成雾霾的原因之一,汽车尾气含CO、NO等有毒气体。为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g); ΔH = -566kJ·moL-1
2H2(g)+O2(g)=2H2O(g); ΔH = -483.6KJ·moL-1
H2O (g)=H2O(l); ΔH = -44.0KJ·moL-1
(1)氢气燃烧热ΔH=__________;
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式______________。
(3)往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1(方程式中各物质前化学计量数为最简整数比),则t℃时CO的转化率为________;反应达到平衡后,升高温度,此时平衡常数将____(填“变大”、“不变”或“变小”)。
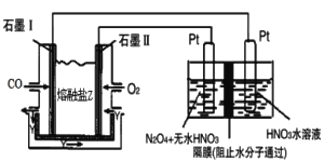
(4)从汽车尾气中分离出CO与O2、熔融盐Na2CO3组成的燃料电池,同时采用电解法制备N2O5,装置如图所示,其中Y为CO2。写出石墨I电极上发生反应的电极反应式_______________________________。在电解池中生成N2O5的电极反应式为__________________________________。
(5)在一定条件下,用NH3处理汽车尾气中的NO。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
【答案】 -285.8 kJ·moL-1 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41. 2KJ·moL-1 83.3% 减小 CO + CO32--2e- = 2CO2 N2O4 + 2HNO3—2e— = 2N2O5 +2H+ 0.3mol或0.8mol
【解析】(1)由2H2(g)+O2(g)=2H2O(g); ΔH =-483.6KJ·moL-1、2H2O (g)=2H2O(l); ΔH =-88.0KJ·moL-1,即2mol氢气燃烧生成液态水,放出的热量为483.6kJ+88kJ=571.6kJ,则1mol氢气燃烧生成液态水时放出的热量为571.6kJ÷2=285.8kJ,所以氢气的燃烧热为-285.8 kJmoL-1;(2)由①2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、②2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol,根据盖斯定律可知(①②)/2得CO(g)+H2O(g)═CO2(g)+H2(g)的反应热△H=[566kJ/mol(483.6kJ/mol)]/2=-41.2kJ/mol,即热化学反应方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol;(3)根据方程式可知
CO(g)+H2O(g)═CO2(g)+H2(g)
开始(mol/L) 0.2 1 0 0
转化(mol/L) x x x x
平衡(mol/L) 0.2-x 1-x x x
t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则x×x/(0.2x)×(1x)=1,解得x=1/6,所以CO的转化率为1/(6×0.2)×100%=83.3%;该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小;(4)燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CO+CO32--2e-=2CO2;N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为N2O4+2HNO3-2e—=2N2O5+2H+;(5)反应的方程式为:6NO+4NH3=5N2+6H2O,6molNO还原得到3molN2,4molNH3,氧化得到2molN2,两者相差1molN2,现相差1.4g,物质的量=1.4g÷28g/mol=0.05mol,相当于0.3molNO和0.2molNH3反应,依题意NO和NH3的总物质的量为1mol,其中必有一种为过量,所以有两种情况:0.3molNO和0.7molNH3或0.2molNH3和0.8molNO。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知下表均为烷烃分子的化学式,且它们的一氯取代物只有一种
1 | 2 | 3 | 4 | 5 | 6 | … |
CH4 | C2H6 | C5H12 | C8H18 | C17H36 | … | … |
则第6项烷烃分子的化学式
A.C16H34B.C22H46C.C26H54D.C27H56