题目内容
【题目】亚氯酸钠是一种高效氧化剂、漂白剂,主要用于亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等含氯微粒,经测定,25 ℃时各组分含量随pH变化情况如图所示(部分没有画出)。则下列分析不正确的是

A. 亚氯酸钠在碱性条件下较稳定
B. 25 ℃时,HClO2的电离平衡常数Ka=10-6
C. 25 ℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-)
D. 等浓度的HClO2溶液和NaClO2溶液等体积混合的溶液中(pH<7):c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)
【答案】C
【解析】
A、由图可以得出:碱性条件下ClO2-浓度高,即在碱性条件下亚氯酸钠较稳定,故A正确;
B、HClO2的电离平衡常数K=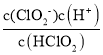 ,观察图像可以看出,当pH=6时,c(ClO2-)=c(HClO2),因此HClO2的电离平衡常数的数值Ka=10-6,故B正确;
,观察图像可以看出,当pH=6时,c(ClO2-)=c(HClO2),因此HClO2的电离平衡常数的数值Ka=10-6,故B正确;
C、若没有氯离子,依据电中性原则得出:c(H+)+c(Na+)=c(ClO2-)+c(OH-),但溶液中含有氯离子其浓度变化没有画出,故C错误;
D、等浓度的HClO2溶液和NaClO2溶液等体积混合的溶液的pH<7,说明溶液显酸性,说明HClO2的电离大于ClO2-离子的水解,溶液中有关微粒的浓度由大到小的顺序为c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-),故D正确;
故选C。

练习册系列答案
相关题目




