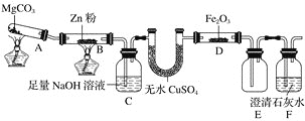
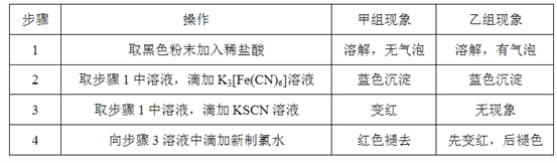
题目内容
【题目】(1)已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是____________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式是_________________________;
负极的电极反应式是_________________________。
(3)右图是一个电解过程示意图。
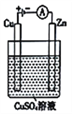
①锌片上发生的电极反应式是______________________。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
【答案】 N2H4(l)+O2(g)=N2(g)+2H2O(l) △H =-624 kJ·mol-1 O2+2H2O+4e-=4OH- N2H4+4OH--4e-=4H2O+N2↑ Cu2++2e-=Cu 112
【解析】(1)32.0g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(2)燃料电池中,正极上是氧气发生得电子的还原反应,在碱性环境下,电极反应式为:2H2O+O2+4e-=4OH-,负极上肼失去电子生成氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,故答案为:2H2O+O2+4e-=4OH-;N2H4+4OH--4e-=4H2O+N2↑;
(3)①锌为阴极,发生还原反应生成铜,电极方程式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
②电解硫酸铜溶液时,铜电极上铜失电子发生氧化反应,当铜片的质量变化128g,失去电子的物质的量=![]() ×2=4mol,1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=
×2=4mol,1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=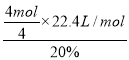 =112L,故答案为:112。
=112L,故答案为:112。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案