题目内容
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中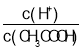 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
【答案】D
【解析】
A.向0.1mol·L-1 CH3COOH溶液中加入少量水促进醋酸电离,醋酸根离子浓度减小,溶液中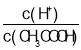 =
=![]() 增大,故A错误;
增大,故A错误;
B.水解是吸热反应,将CH3COONa溶液从20℃升温至30℃,水解常数Kh增大,溶液中![]() 减小,故B错误;
减小,故B错误;
C.向盐酸中加入氨水至中性,溶液中电荷守恒为c(NH4+)+c(H+)=c(OH-)+c(Cl-)得到c(NH4+)=c(Cl-),![]() =1,故C错误;
=1,故C错误;
D.AgCl+Br-![]() Cl-+AgBr的平衡常数为K=
Cl-+AgBr的平衡常数为K=![]() ,只受温度的影响,故D正确;
,只受温度的影响,故D正确;
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】煤的气化是高效、清洁的利用煤炭的重要途径之一。
①C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
②CO(g)+![]() O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g)ΔH=-241.8kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8kJ·mol-1
(1)则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是_______,该反应的化学平衡常数K随温度的升高将_______(填“增大”、“减小”或“不变”)。
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
H2O | CO | CO2 | H2 | |
甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
乙 n/mol | 0.20 | 0.20 | 0 | 0 |
起始时,甲容器中反应向____________(填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为___________。