题目内容
【题目】(1)根据下列图示,写出反应的热化学方程式。

A.___________________________________。
B.___________________________________。
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式为___________________。
(3)如图是598 K时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为_________。
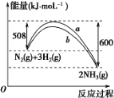
【答案】CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol1CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41 kJ·mol1S(s)+O2(g)=SO2(g) ΔH=296.8 kJ·mol1N2(g)+3H2(g)![]() 2NH3(g) ΔH=92 kJ·mol1
2NH3(g) ΔH=92 kJ·mol1
【解析】
(1)根据图像可知A图中反应物总能量高于生成物总能量,是放热反应,反应热是41 kJ·mol1,B图中反应物总能量低于生成物总能量,是吸热反应,反应热是+41 kJ·mol1,因此热化学方程分别为:
A、CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol1;
B、CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41 kJ·mol1;
(2)16 g固体硫的物质的量是0.5mol,完全燃烧时放出148.4 kJ的热量,则1mol固体硫完全燃烧时放出2×148.4 kJ=296.8 kJ的热量,因此该反应的热化学方程式为S(s)+O2(g)=SO2(g) ΔH=296.8 kJ·mol1。
(3)根据图像可知反应物总能量高于生成物总能量,是放热反应,反应热ΔH=508 kJ/mol-600 kJ/mol=-92 kJ/mol,因此该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=92 kJ·mol1。
2NH3(g) ΔH=92 kJ·mol1。

【题目】现有① SiO2② Na2CO3③ (NH4)2CO3④ Al(OH)3四种物质,其中既能与盐酸反应,又能与NaOH溶液反应的是( )
A. ① ② B. ② ④ C. ③ ④ D. ① ② ③
【题目】四个体积相同的密闭容器中,在一定条件下发生反应:反应开始时,反应速率最大的是
容器 | 温度 | N2(mol) | H2(mol) | 催化剂 |
A | 500 | 2 | 6 | 有 |
B | 500 | 1.5 | 4.5 | 无 |
C | 450 | 1.5 | 4.5 | 无 |
D | 450 | 2 | 6 | 无 |
A.AB.BC.CD.D


