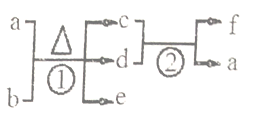
题目内容
【题目】硫化氢是天然气及石油中含硫杂质,近年来发现H2S可用于高效制取氢气。回答下列问题:
(1)H2S可用FeCl3溶液、NaClO溶液及氨水等吸收。
①FeCl3溶液吸收H2S气体,该反应的还原产物为_________。
②NaClO溶液吸收H2S,氧化剂与还原剂的物质的量之比为4:1,则该反应的离子方程式
为___________。
(2) Linkkous等学者通过多硫化物作循环液,设计出如下四步反应:
(Ⅰ)H2S+OH-=HS-+H2O (Ⅱ)2HS-+H2O![]() H2↑+S22-
H2↑+S22-
(Ⅲ)H2S+S22-=2HS-+S↓ (Ⅳ)HS-+H2O=H2S+OH-
四步反应的总反应的化学方程式为__________________;能量转化方式为______。
(3)克劳斯法脱硫包含的反应为:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H1
2H2S(g)+ SO2(g)=3S(s)+ 2H2O(l) △H2
H2S(g)+ ![]() O2(g)= S(s)+ 2H2O(l) △H3
O2(g)= S(s)+ 2H2O(l) △H3
①△H3=_________(用△H1、△H2表示)。
②为了达到较好的脱硫率,除采用多级脱硫外,还可采取的措施是___________________。
(4)硫化氢裂解制氢气的反应为2H2S(g) ![]() S2 (g)+2H2 (g),设起始时容器中只有H2S,平衡时三种物质的组成与裂解温度关系如图所示。
S2 (g)+2H2 (g),设起始时容器中只有H2S,平衡时三种物质的组成与裂解温度关系如图所示。
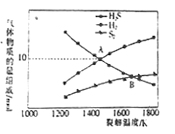
①A点时,H2S的转化率为_______________。
②B点时,设容器的总压为p Pa,则平衡常数Kp为________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】 Fe2+(或FeCl2) 4ClO-+H2S═4Cl-+SO42+2H+ H2S ![]() H2↑+S↓ 光能转化为化学能
H2↑+S↓ 光能转化为化学能 ![]() 控制
控制![]() =2(或其他合理答案) 50% pPa
=2(或其他合理答案) 50% pPa
【解析】 (1)①氯化铁具有氧化性氧化硫化氢为硫单质,反应的离子方程式为:2Fe3++H2S═2Fe2++2H++S↓,反应中铁元素的化合价降低,被还原,还原产物为Fe2+,故答案为:Fe2+;
②NaClO具有氧化性是氧化剂, H2S是还原剂,氧化剂与还原剂的物质的量之比为4:1,反应的离子方程式为4ClO-+H2S═4Cl-+SO42+2H+,故答案为:4ClO-+H2S═4Cl-+SO42+2H+;
(2) 将(Ⅰ)×2+ (Ⅱ)+ (Ⅲ)+ (Ⅳ)的四步反应的总反应的化学方程式为H2S ![]() H2↑+S↓;根据反应方程式可知,该反应的本质是在催化剂作用下利用光能将硫化氢分解,能量转化方式为光能转化为化学能,故答案为:H2S
H2↑+S↓;根据反应方程式可知,该反应的本质是在催化剂作用下利用光能将硫化氢分解,能量转化方式为光能转化为化学能,故答案为:H2S ![]() H2↑+S↓;光能转化为化学能;
H2↑+S↓;光能转化为化学能;
(3) ①i.2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H1,ii.2H2S(g)+ SO2(g)=3S(s)+ 2H2O(l) △H2,根据盖斯定律,将(i+ii×2)×![]() ,得:H2S(g)+
,得:H2S(g)+ ![]() O2(g)= S(s)+ 2H2O(l) △H3=
O2(g)= S(s)+ 2H2O(l) △H3=![]() ,故答案为:
,故答案为: ![]() ;
;
②根据反应H2S(g)+ ![]() O2(g)= S(s)+ 2H2O(l),控制
O2(g)= S(s)+ 2H2O(l),控制![]() =2,可以达到较好的脱硫率,故答案为:控制
=2,可以达到较好的脱硫率,故答案为:控制![]() =2;
=2;
(4) ①根据图像,A点时,硫化氢和氢气的物质的量相等,根据2H2S(g) ![]() S2 (g)+2H2 (g),说明反应的硫化氢与剩余的硫化氢相等,H2S的转化率为50%,故答案为:50%;
S2 (g)+2H2 (g),说明反应的硫化氢与剩余的硫化氢相等,H2S的转化率为50%,故答案为:50%;
②根据A点可知,起始时硫化氢为20mol,B点时,硫化氢与S2的物质的量相等,设分解的硫化氢为x,则20-x=![]() ,解得x=
,解得x=![]() mol,容器中含有H2S
mol,容器中含有H2S![]() mol,S2
mol,S2![]() mol ,H2
mol ,H2![]() mol,物质的量分数分别为
mol,物质的量分数分别为![]() ,
, ![]() ,
, ![]() ,平衡常数Kp=
,平衡常数Kp=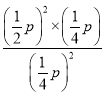 =p,故答案为:p。
=p,故答案为:p。

【题目】短周期元素甲~戊在元素周期表中的相对位置如下表所示,下列判断正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A. 原子半径:甲>乙
B. 原子核外电子层数:乙<丁
C. 原子最外层电子数:丙>丁>戊
D. 元素的最高价氧化物对应水化物的碱性:丙<戊
【题目】工业上用含锰废料(主要成分MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如下:
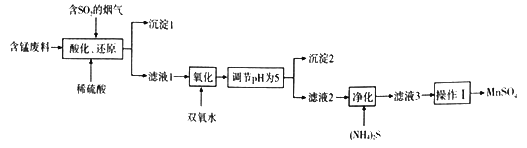
已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如下表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.0×10-33 | 4.0×10-38 | 2.0×10-20 | 4.0×10-14 |
请回答:
(1)沉淀1的化学式为__________________。
(2)(NH4)2S的电子式为________________;“净化”时,加入(NH4)2S的作用为___________________。
(3)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为__________________。
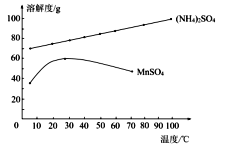
(4)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如下图所示。
据此判断,操作“I”应为蒸发浓缩、____________、洗涤、干燥。
(5)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为________________。
(6)25.35 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
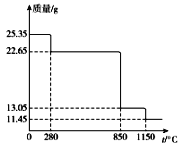
①300℃时,所得固体的化学式为______________________。
②1150℃时,反应的化学方程式为___________________。