题目内容
醋酸溶液中存在电离平衡CH3COOH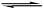 H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
B
解析试题分析:A正确,符号电荷守恒;稀释促进电离,都能溶液中氢离子浓度是降低的,因此溶液中c(OH-)增大,B不正确;根据醋酸的电离方程式可知,增大醋酸根离子浓度,抑制电离,C正确;常温下pH=2的CH3COOH溶液浓度大于0.01mol/L,反应中醋酸是过量的,反应后溶液显酸性,D正确,答案选B。
考点:考查弱电解质的电离
点评:电离平衡也是一种动态平衡,适用于勒夏特例原理,据此可以进行有关判断。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目