题目内容
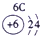
(23分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA |
| 0 | |||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 |
|
|
| ② | ③ | ④ |
|
|
3 | ⑤ |
| ⑥ | ⑦ |
|
| ⑧ |
|
Ⅰ.(1)④、⑤、⑥的原子半径由大到小的顺序为 。
(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)由表中两种元素的原子按11组成的常见液态化合物的稀液易被催化分解,其结构式为 ,它非常容易被一种日常常见过渡金属离子还原,在酸性条件的离子反应方程式为 。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
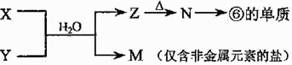
X溶液与Y溶液反应的离子方程式为 。常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 ;若Y与M混合则可使溶液呈碱性,此时溶液中离子浓度大小顺序为 。(填一种合理即可)
Ⅱ.实验室制取③的氢化物的方程式为 ,已知该氢化物与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
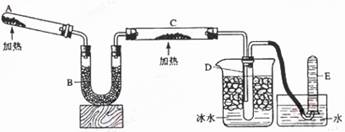
回答下列问题:
(1)B中加入的物质是 ,其作用是 。
(2)实验时在C中观察到得现象是 ,发生反应的化学方程式是 。
(3)D中收集到的物质是 ,检验该物质的方法和现象是 。
Ⅰ.(1)Na>Al>O (1分)
(2)![]() 或
或![]() (1分)
(1分)
(3)H-O-O-H(1分), H2O2+2Fe2++2H+=2H2O+2Fe3+
(4)Al3++3NH3?H2O=Al(OH)3↓+3NH4+ , PH=7,
C(NH4+)>C(Cl-)>C(OH-)>C(H+), C(NH4+)>C(NO3-)>C(OH-)>C(H+)
Ⅱ. 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(1)碱石灰(或CaO)(1分), 除去NH3气流中的水蒸气
(2)黑色粉末部分逐渐变为红色 2NH3+3CuO![]() N2+3H2O+3Cu
N2+3H2O+3Cu
(3)氨水(1分), 用红色石蕊试纸检验、试纸变蓝 (其余均为2分)

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案








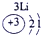
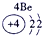
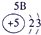
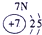
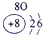
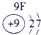
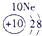
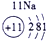





 表示的是
表示的是