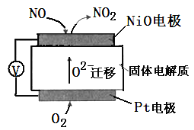
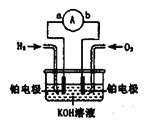
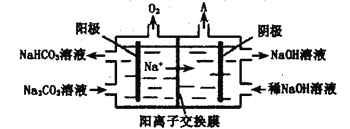
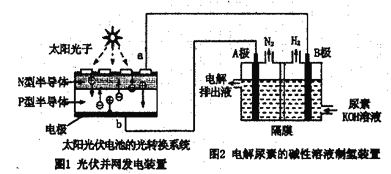
题目内容
【题目】对实验Ⅰ~Ⅳ的实验现象预测正确的是
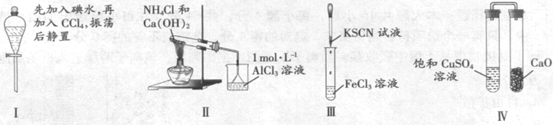
A. 实验I:液体分层,下层呈无色
B. 实验II:烧杯中先出现白色沉淀,后溶解
C. 实验III:试管中溶液颜色变为红色
D. 实验IV:放置一段时间后,饱和硫酸铜溶液中出现蓝色晶体
【答案】CD
【解析】
试题分析:实验Ⅰ因CCl4的密度比水大,因此液体分层后,下层呈紫红色,上层呈无色,A项错误;实验Ⅱ生成的NH3与AlCl3溶液可生成Al(OH)3沉淀,但因NH3·H2O碱性较弱,Al(OH)3不能溶解在氨水中,B项错误;KSCN溶液与FeCl3溶液可反应生成红色的Fe(SCN)3,溶液呈红色,C项正确;实验Ⅳ中,因CaO具有较强的吸水性,可使装置左侧饱和CuSO4溶液中的水分减少,导致蓝色CuSO4·5H2O晶体析出,D项正确,所以答案选CD。

练习册系列答案
相关题目
【题目】用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
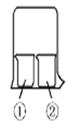
①中的物质 | ②中的物质 | 预测①中现象 | |
A | 淀粉碘化钾溶液 | 浓硝酸 | 无明显现象 |
B | 酚酞溶液 | 浓盐酸 | 无明显现象 |
C | 氯化铝溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. A B. B C. C D. D