题目内容
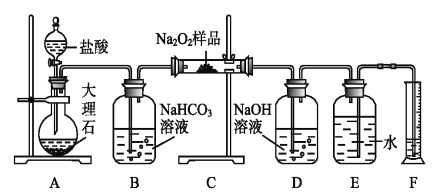
【题目】我国科研工作者发展了阴极还原电沉积制备高性能氧化铈电极材料的新方法。以石墨为电极,经历以下过程:①在电场的作用下,将电解液中的硝酸根离子插入石墨层间;②改变电流方向,已插入的和到达电极附近的NO3-放电,产生OH-和NO![]() ;③OH-与Ce3+结合形成氢氧化铈,氢氧化铈进一步失水氧化形成氧化铈(CeO2)。图示如图。已知298K时,Ksp[Ce(OH)3]=1×10-20,当离子浓度≤10-5mol·L-1时,可认为沉淀完全。下列说法错误的是( )
;③OH-与Ce3+结合形成氢氧化铈,氢氧化铈进一步失水氧化形成氧化铈(CeO2)。图示如图。已知298K时,Ksp[Ce(OH)3]=1×10-20,当离子浓度≤10-5mol·L-1时,可认为沉淀完全。下列说法错误的是( )

A.过程①,1接3,2接4;过程②,1接5,2接6
B.过程②,阴极电极反应为NO![]() +H2O+2e-=2OH-+NO
+H2O+2e-=2OH-+NO![]()
C.室温下,要保证电解液中Ce3+沉淀完全,阴极附近溶液的pH应不小于9
D.过程③,发生的反应为Ce3++3OH-=Ce(OH)3↓,4Ce(OH)3+O2=4CeO2+6H2O
【答案】A
【解析】
A.过程①的目的是在电场作用下,将电解液中的硝酸根离子插入石墨层间,阴离子移动到石墨层,根据在电解池中,阴离子向阳极移动,由图示可判断右边为阳极,接电源的正极,所以2接6,1接5;过程②,已插入和到达电极附近的NO3-放电,产生OH-和NO![]() ,N元素由+5价变为+3价,得电子被还原,发生还原反应,在电解池中,发生还原反应在阴极区,所以1接3,2接4,故A错误;
,N元素由+5价变为+3价,得电子被还原,发生还原反应,在电解池中,发生还原反应在阴极区,所以1接3,2接4,故A错误;
B.过程②,阴极NO3-发生还原反应,因需要产生OH-,反应式前面需要加H2O而不是H+,电极反应式为NO3-+H2O+2e-=2OH-+NO2-,故B正确;
C.电解液中Ce3+沉淀完全时,c(Ce3+)≤1×10-5mol·L-1,根据Ce(OH)3化学式,得Ksp=1×10-20=c(Ce3+)×c3(OH-),所以c(OH-)=
![]() =1×10-5mol·L-l,阴极附近溶液的c(OH-)≥1×10-5mol·L-l,则pH≥9,故C正确;
=1×10-5mol·L-l,阴极附近溶液的c(OH-)≥1×10-5mol·L-l,则pH≥9,故C正确;
D.过程③OH-与Ce3+结合形成氢氧化铈,氢氧化铈进一步失水氧化形成氧化铈(CeO2),发生的反应为Ce3++3OH-=Ce(OH)3↓,4Ce(OH)3+O2=4CeO2+6H2O,故D正确;
答案为A。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案【题目】一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g) + O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | t1 | t2 | t3 | t4 |
n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是
A.反应在前t1s 的平均速率v(O2) = 0.4/t1mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大