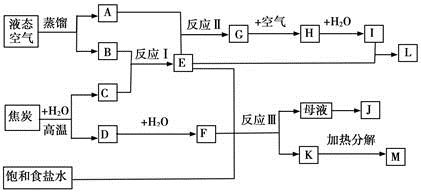
题目内容
下列工业生产中,各物质的物质的量间的关系式不正确的是( )
| A.制漂白粉:2Cl2~Ca(ClO)2 |
| B.制H2SO4:FeS2~2H2SO4 |
| C.合成氨:C~H2~2/3NH3 |
| D.制HNO3:NH3~HNO3 |
C
A中的化学反应方程式是2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;B中的反应是4FeS2+11O2=2Fe2O3+8SO2,2SO2+O2 2SO3,SO3+H2O=H2SO4,根据S原子守恒可得B是正确的;C中的反应是C+H2O=CO+H2,CO+H2O=CO2+H2,N2+3H2
2SO3,SO3+H2O=H2SO4,根据S原子守恒可得B是正确的;C中的反应是C+H2O=CO+H2,CO+H2O=CO2+H2,N2+3H2 2NH3,可得C中的关系应为3C~6H2~4NH3;D中的反应是4NH3+5O2=4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,其中后两个反应循环进行,所以可用一个总反应表示:4NO+3O2+2H2O=4HNO3;由上述关系可得D选项是正确的。
2NH3,可得C中的关系应为3C~6H2~4NH3;D中的反应是4NH3+5O2=4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,其中后两个反应循环进行,所以可用一个总反应表示:4NO+3O2+2H2O=4HNO3;由上述关系可得D选项是正确的。
 2SO3,SO3+H2O=H2SO4,根据S原子守恒可得B是正确的;C中的反应是C+H2O=CO+H2,CO+H2O=CO2+H2,N2+3H2
2SO3,SO3+H2O=H2SO4,根据S原子守恒可得B是正确的;C中的反应是C+H2O=CO+H2,CO+H2O=CO2+H2,N2+3H2 2NH3,可得C中的关系应为3C~6H2~4NH3;D中的反应是4NH3+5O2=4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,其中后两个反应循环进行,所以可用一个总反应表示:4NO+3O2+2H2O=4HNO3;由上述关系可得D选项是正确的。
2NH3,可得C中的关系应为3C~6H2~4NH3;D中的反应是4NH3+5O2=4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,其中后两个反应循环进行,所以可用一个总反应表示:4NO+3O2+2H2O=4HNO3;由上述关系可得D选项是正确的。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


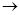 CaCO3↓+2NaOH
CaCO3↓+2NaOH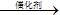 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑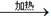 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O CaCl2+2Cl2↑+2H2O
CaCl2+2Cl2↑+2H2O

 2NH3(g) ΔH<0; 2SO2(g)+O2(g)
2NH3(g) ΔH<0; 2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0