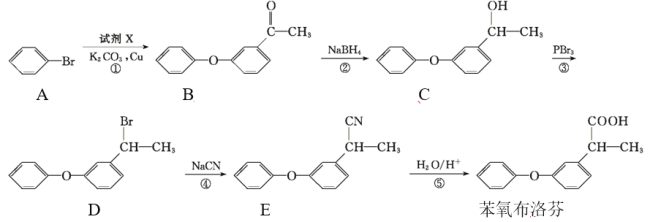
题目内容
【题目】氯气是现代工业的重要原料,将氯化氢转化为氯气的技术成为科学研究的热车点,回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反应Ⅰ能自发进行的条件是___。利用ΔH1和ΔH2计算ΔH3时,还需要利用反应___的ΔH。
(2)如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
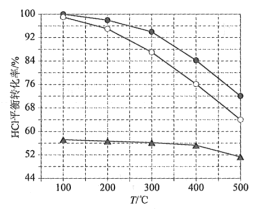
可知反应平衡常数K(400℃)__K(500℃)(填“大于”或“小于”)。设容器内初始压强为p0,根据进料浓度比c(HCl):c(O2)=4:1的数据,计算400℃时容器内的平衡压强=___(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2)过低、过高的不利影响分别是___。
(3)已知:氯气与NaOH溶液反应可生成NaClO3。有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:___。
(4)电解NaClO3水溶液可制备NaClO4,写出阳极反应式:___。
【答案】高温 CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) 大于 0.848p0 Cl2和O2分离能耗较高、HCl转化率较低 反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化 ClO3-+H2O-2e-=ClO4-+2H+
【解析】
(1)Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1,△S>0,则要△G=△H-T△S<0,须高温条件下才能自发;
Cl2(g) ΔH1=+83kJ·mol-1,△S>0,则要△G=△H-T△S<0,须高温条件下才能自发;
Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
利用ΔH1和ΔH2计算ΔH3时,由盖斯定律,(Ⅲ-Ⅱ×2-Ⅰ×2)/2得:还需要利用反应CuO(s)+2HCl(g)=CuCl2(s)+H2O(g)的ΔH。
故答案为:高温;CuO(s)+2HCl(g)=CuCl2(s)+H2O(g);
(2)根据图象可知,进料浓度比相同时,温度越高HCl平衡转化率越低,说明该反应为放热反应,升高温度平衡向着逆向移动,则温度越高平衡常数越小,所以反应平衡常数K(400℃)大于K(500℃);进料浓度比c(HCl):c(O2)的比值越大,HCl的平衡转化率越低,根据图象可知,相同温度时HCl转化率最高的为进料浓度比c(HCl):c(O2)=4:1,该曲线中400℃HCl的平衡转化率为76%。则

p=![]() p0=0.848p0;
p0=0.848p0;
进料浓度比c(HCl):c(O2)过低时,O2浓度较大,HCl的转化率较高,但Cl2和O2分离能耗较高,生成成本提高;进料浓度比c(HCl):c(O2)过高时,O2浓度较低,导致HCl的转化率减小;
故答案为:大于;p=![]() p0=0.848p0;Cl2和O2分离能耗较高、HCl转化率较低;
p0=0.848p0;Cl2和O2分离能耗较高、HCl转化率较低;
(3)生成NaClO3的反应分两步进行:Ⅰ.2ClO-=ClO2-+Cl-,Ⅱ.ClO2-+ClO-=ClO3-+Cl-,常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,用碰撞理论解释其原因:反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化;
故答案为:反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化;
(4)电解NaClO3水溶液可制备NaClO4,阳极发生氧化反应生成ClO4-,阳极反应式:ClO3-+H2O-2e-=ClO4-+2H+。
故答案为:ClO3-+H2O-2e-=ClO4-+2H+。

 阅读快车系列答案
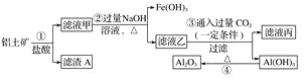
阅读快车系列答案【题目】一种从冶铅废渣中提取铅的工艺流程如图所示:

已知:醋酸铅易溶于水,难电离。火法炼铅是将方铅矿(主要成分为PbS)在空气中焙烧,生成PbO和SO2。
回答下列问题:
(1)用方铅矿火法炼铅的反应的化学方程式为______。
(2)火法炼铅的废气中含SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为_____。
(3)冶铅废渣用硫酸洗涤后,生成的PbSO4表面常含有铜单质,为了溶解铜单质,常需要同时加入一定量的H2O2溶液,写出溶解铜单质发生反应的离子方程式_______;为加快此反应的速率,下列方法合理的是_____(填标号)。
A.搅拌 B.适当加热 C.减压
(4)将饱和Na2CO3溶液加入滤渣1中发生的反应为![]() (aq)+PbSO4(s)
(aq)+PbSO4(s)![]() PbCO3(s)+
PbCO3(s)+![]() (aq),以PbCO3和焦炭为原料在高温条件下可制备金属铅,用化学方程式表示制备过程_______。
(aq),以PbCO3和焦炭为原料在高温条件下可制备金属铅,用化学方程式表示制备过程_______。
(5)工业上常用等体积的饱和NaHCO3溶液代替饱和Na2CO3溶液,将一定量的PbSO4转化为PbCO3。PbSO4与NaHCO3或Na2CO3的物质的量之比不同时,PbSO4的转化率如表所示。
Ⅰ | n(PbSO4)∶n(NaHCO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4的转化率% | 95.5 | 96.9 | 97.8 | |
Ⅱ | n(PbSO4)∶n(Na2CO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4的转化率% | 98 | 98 | 98 |
依据表中数据,物质的量之比相同时,Ⅱ中PbSO4的转化率比Ⅰ中的略大,原因是______。