题目内容
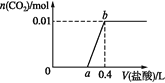
【题目】已知拆开1molH2(g)中的H-H键需要消耗436kJ能量,如图反应3H2(g)+N2(g) ![]() 2NH3(g)的能量变化示意图.下列说法不正确的是
2NH3(g)的能量变化示意图.下列说法不正确的是

A. 断开1 mol N2(g)中的N![]() N键要吸收941 kJ能量
N键要吸收941 kJ能量
B. 生成2mol NH3(g)中的N-H键吸收2346 kJ能量
C. 3H2(g) + N2(g) ![]() 2NH3(g) △H=-97
2NH3(g) △H=-97![]()
D. NH3(g) ![]() 3/2H2(g) +1/2 N2(g) △H=48.5
3/2H2(g) +1/2 N2(g) △H=48.5 ![]()
【答案】B
【解析】
A.拆开1molH2(g)中的H﹣H键需要消耗436kJ能量,图中断裂化学键吸收能量为2249kJ,则断开1 mol N2(g)中的N≡N键要吸收能量为2249kJ﹣436kJ×3=941 kJ,故A正确;
B.图中生成2mol NH3(g)时形成化学键释放的能量为2346kJ,而断裂化学键吸收能量,故B错误;
C.由图可知△H=(2249﹣2346)kJ/mol=﹣97 kJmol﹣1,即热化学方程式为3H2(g)+N2(g)2NH3(g)△H=﹣97 kJmol﹣1,故C正确
D.互为逆反应时焓变的数值相同、符号相反,且物质的量与热量成正比,由3H2(g)+N2(g)2NH3(g)△H=﹣97 kJmol﹣1可知NH3(g)![]() H2(g)+
H2(g)+![]() N2(g)△H=48.5kJmol﹣1,故D正确;
N2(g)△H=48.5kJmol﹣1,故D正确;
故答案为B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目