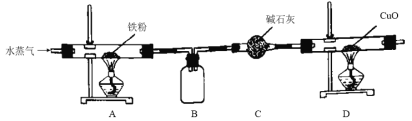
题目内容
【题目】已知:将C12通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且![]() 的值仅与温度高低有关。当n(NaOH)=6amol时,下列有关说法正确的是
的值仅与温度高低有关。当n(NaOH)=6amol时,下列有关说法正确的是
A.改变温度,反应中转移电子的物质的量n的范围:3amol≤n≤5amol
B.改变温度,产物中NaCl的最小理论产量为4amol
C.参加反应的氯气的物质的量3amol
D.某温度下,若反应后![]() =6,则溶液中
=6,则溶液中![]() =
=![]()
【答案】AC
【解析】
C12与NaOH溶液反应可以按照两种反应进行,①3C12+6NaOH=5NaCl+NaClO3+3H2O,②C12+2NaOH=NaCl+NaClO+H2O;
A.如果按照①反应,转移电子物质的量为5amol,如果按照②反应,转移电子物质的量为3amol,改变温度,反应中转移电子的物质的量n的范围:3amol≤n≤5amol,A正确;
B.按照①进行生成NaCl 5amol,按照②进行生成NaCl 3amol,故生成NaCl的物质的量的范围:3amol~5amol,B错误;
C.根据方程式可知,无论按照哪种反应进行,反应的氯气的物质的量均为3amol,C正确;
D.设按照①进行反应的NaOH的物质的量为xamol,则按照②进行反应的NaOH的物质的量为(6—x)amol,生成的NaCl物质的量为[![]() ]mol,NaClO物质的量为
]mol,NaClO物质的量为![]() mol,NaClO3为
mol,NaClO3为![]() mol,根据
mol,根据![]() =6,解得x=
=6,解得x=![]() ,因此
,因此![]() =6,D错误;
=6,D错误;
答案选AC。

 阅读快车系列答案
阅读快车系列答案【题目】在体积恒定为3L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)上述反应涉及三种元素,其中原子半径最大的元素核外电子排布式为_________,原子核外电子运动状态最多的元素是_______(写元素符号)。
(2)上述反应所涉及的四种物质中非极性分子的沸点顺序是_____,其主要原因是_________。
(3)该反应的化学平衡常数表达式为_______;该反应的正方向是________反应(选填“吸热”、放热)
(4)某温度下,2min内生成10.8g H2O(g),用CO浓度变化表示这段时间内的平均反应速率为____________;若平衡时各物质浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为_________℃
(5)能判断该反应是否达到化学平衡状态的依据是_______
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)