题目内容
 (1)中国古代四大发明之一--黑火药,它的爆炸反应为:2KNO3+3C+S
(1)中国古代四大发明之一--黑火药,它的爆炸反应为:2KNO3+3C+S
| ||
. |
①除S外,上列元素的电负性从大到小依次为
②在生成物中,含极性共价键的分子的中心原子轨道杂化类型为
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
(2)原子序数小于36的过渡元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子(价电子)排布为
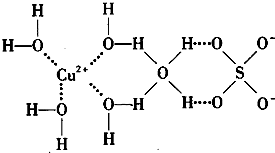
(3)科学家通过X-射线推测胆矾中既含有配位键,又含有氢键,其结构示意图如图所示,其中配位键和氢键均采用虚线表示.
①写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)
②水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响:
分析:(1)①同周期自左而右电负性增大,金属性越强电负性越小,据此解答;
②含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,再经过核外电子排布规律解答;
(3)①CuSO4?5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4;
②氢键较一般分子间作用力强,影响物质的物理性质.
②含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,再经过核外电子排布规律解答;
(3)①CuSO4?5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4;
②氢键较一般分子间作用力强,影响物质的物理性质.
解答:解:(1)①同周期自左而右电负性增大,金属性越强电负性越小,故电负性O>N>C>K,
故答案为:O>N>C>K;
②含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2,为sp杂化方式,故答案为:sp杂化;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为1:1,
故答案为:1:1;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,Ni元素是28号元素,Ni原子价电子排布式为3d84s2,Fe2+的核外电子排布式为1s24s22p63s23d6,3d能级有4个单电子,
故答案为:3d84s2;4;
(3)①CuSO4?5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4.水合铜离子的结构简式为 ,
,
故答案为: ;
;
②氢键较一般分子间作用力强,所以水的熔、沸点较高,由于氢键具有方向性,结冰时,氢键增多,体积增大,密度减小,
故答案为:水的熔、沸点较高;结冰时密度减小.
故答案为:O>N>C>K;
②含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2,为sp杂化方式,故答案为:sp杂化;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为1:1,
故答案为:1:1;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,Ni元素是28号元素,Ni原子价电子排布式为3d84s2,Fe2+的核外电子排布式为1s24s22p63s23d6,3d能级有4个单电子,
故答案为:3d84s2;4;
(3)①CuSO4?5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4.水合铜离子的结构简式为
 ,
,故答案为:
 ;
;②氢键较一般分子间作用力强,所以水的熔、沸点较高,由于氢键具有方向性,结冰时,氢键增多,体积增大,密度减小,
故答案为:水的熔、沸点较高;结冰时密度减小.
点评:本题考查电负性、杂化轨道、原子核外电子排布规律、等电子体、配位键等,难度较大,注意对基础知识的理解掌握,注意(2)中元素推断,整体把握元素周期表.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
(3)在CrCl3的水溶液中,一定条件下存在组成为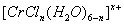 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCl3(H2O)6-n]x+ +xR-H Rx[CrCl3(H2O)6-n]x+ +xH+
Rx[CrCl3(H2O)6-n]x+ +xH+
交换出来的经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol 的溶液,与R-H完全交换后,中和生成的需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为__________________ 。
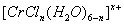 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应: [CrCl3(H2O)6-n]x+ +xR-H
 Rx[CrCl3(H2O)6-n]x+ +xH+
Rx[CrCl3(H2O)6-n]x+ +xH+交换出来的经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol 的溶液,与R-H完全交换后,中和生成的需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为__________________ 。