题目内容
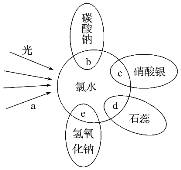
【题目】(1)某反应中反应物与生成物有:FeSO4、Fe2(SO4)3、CuSO4、Cu。将上述反应设计成的原电池如图(1)所示,请回答下列问题:
①溶液X是____________溶液;
②Cu电极上发生的电极反应式为__________________________________________;

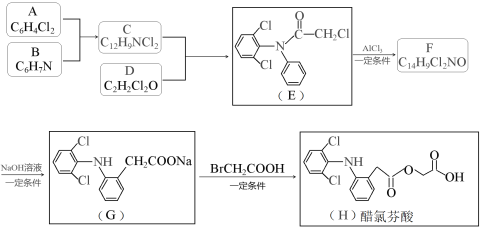
(2)一种熔融碳酸盐燃料电池原理示意如图(2)。
①电极A上CO参与的电极反应式为______________________________。
②电极B处除了通O2外,还需通入的物质A为__________。
③电池工作时,电池内部CO32-的物质的量__________(填“增大”、“减少”或“不变”)。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O![]() Na2FeO4+3H2↑。高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______________________________________。
Na2FeO4+3H2↑。高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______________________________________。
【答案】Fe2(SO4)3 Cu-2e-===Cu2+ CO-2e-+CO32-=2CO2 CO2 不变 2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O
【解析】
(1)①Fe2(SO4)3具有强氧化性,铜能被氧化为铜离子;
②Cu作负极,失电子发生氧化反应;
(2)①一氧化碳变为二氧化碳发生氧化反应;
②电极B为正极,发生还原反应:O2+4e-+2CO2=2CO32-,从极反应可知,需要不断补充CO2;
③根据该原电池的正负极极反应判断电池内部CO32-的物质的量变化情况;
(3)NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,据此写出离子反应方程式。
(1)①Fe2(SO4)3具有强氧化性,铜能被硫酸铁氧化,所以反应为Fe3++Cu=Fe2++Cu2+;则Fe2(SO4)3溶液为电解质溶液;
因此,本题正确答案是: Fe2(SO4)3。
②Cu作负极,失电子发生氧化反应,电极反应为Cu-2e-===Cu2+ ,因此,本题正确答案是: Cu-2e-===Cu2+ 。
(2)①根据图示可知,一氧化碳变为二氧化碳,碳元素化合价升高,发生氧化反应,电极A上CO参与的电极反应式为:CO-2e-+CO32-=2CO2 ;综上所述,本题答案是: CO-2e-+CO32-=2CO2。
②电极B为正极,发生还原反应:O2+4e-+2CO2=2CO32-,从极反应可知,需要不断补充CO2;
综上所述,本题答案是:CO2。
③该反应负极反应为:2CO-4e-+2CO32-=4CO2,正极反应为O2+4e-+2CO2=2CO32-,从以上两个极反应可知,电池工作时,电池内部CO32-的物质的量不变;
综上所述,本题答案是:不变。
(3)NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的方程式为: 2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3NaCl+5H2O,离子方程式为2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O。
综上所述,本题答案是:2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O。

 智慧小复习系列答案
智慧小复习系列答案【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25