题目内容
14.金属氧化性强,则还原性弱,而该金属的离子氧化性也强,还原性也弱.错(判断对错)分析 失电子能力越强的元素对应物质还原性越强,得电子能力越强的元素对应物质氧化性越强,金属在反应中只能失去电子,不能得到电子,据此解答.
解答 解:金属在反应中只能失去电子,不能得到电子,只具有还原性,不具有氧化性,金属失去电子越容易,形成的阳离子越稳定,则阳离子得电子能力越弱,氧化性越弱,故上述说法错误;
故答案为:错.
点评 本题考查了物质氧化性还原性强弱的比较,抓住得失电子的难易是解题关键,题目难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1 L 0.1 mol/L Na2CO3溶液中,阴离子总数大于0.1 NA | |
| B. | 常温常压下,1 mol甘氨酸中含C-H键数目为3 NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA | |
| D. | 50℃时,10 L pH=13的NaOH溶液中含有的OH-数目为NA |
5.化学与人类生产、生活、社会可持续发展等密切相关,下列说法错误的是( )
| A. | 推广使用聚二氧化碳可降解塑料,能减少白色污染 | |
| B. | 通常所说的三大有机合成材料.合成纤维、合成橡胶 | |
| C. | 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 | |
| D. | 实施“煤改气”“煤改电”等清洁燃料改造工程,有利于保护环境 |
2. 尿素是蛋白质代谢的产物,也是重要的化学肥料,工业合成尿素反应如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)
尿素是蛋白质代谢的产物,也是重要的化学肥料,工业合成尿素反应如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s) 将实验测得的不同温度下的平衡数据列于下表:
①关于上述反应的焓变、熵变说法正确的是A.
A.△H<0,△S<0 B.△H>0,△S<0 C.△H>0,△S>0,D.△H<0,△S>0.
 尿素是蛋白质代谢的产物,也是重要的化学肥料,工业合成尿素反应如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)
尿素是蛋白质代谢的产物,也是重要的化学肥料,工业合成尿素反应如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s) 将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0 B.△H>0,△S<0 C.△H>0,△S>0,D.△H<0,△S>0.
9.下列各选项中,原因、结论及因果关系均正确的是( )
| A. | 因为H-F的键能大于H-CI,所以HF的沸点高于HCI | |
| B. | 因为HCIO4比HCIO中的氯元素的化合价高,所以HCIO4的氧化性强于HCIO | |
| C. | 因为N元素的非金属性比P元素强,所以NH3的稳定性强于PH3 | |
| D. | 因为Fe的还原性强于Cu,所以Cu2+的氧化性强于Fe3+ |
19.下列各组物质中属于同分异构体的是( )
| A. | 葡萄糖与蔗糖 | |
| B. | O2和O3 | |
| C. | $\left.\begin{array}{l}{12}\\{6}\end{array}\right.$C与$\left.\begin{array}{l}{13}\\{6}\end{array}\right.$C | |
| D. |  |
6.用下列实验装置进行的相关实验,设计合理且能达到相应实验目的是 ( )
| A. |  装置:石油的分馏 | |
| B. |  装置:测定中和热 | |
| C. | 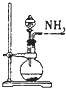 装置:将浓氨水滴加到生石灰中制取氨气 | |
| D. |  装置:加热氯化铵和消石灰混合物,制取并收集氨气 |
8.工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)△H=akJ•mol-1
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | 10min内,T1时CH4的化学反应速率比T2时小 | |
| B. | T1<T2 | |
| C. | 平衡常数:K(T1)<K(T2) | |
| D. | a<0 |
9.现有某化学式为C3H6O3的有机物,其1H核磁共振谱有三个峰,强度之比为3:2:1,则该有机物的结构简式不可能为( )
| A. | CH3CH2COOH | B. | HCOOCH2CH3 | C. | CH3COOCH3 | D. | CH3COCH2OH |