题目内容
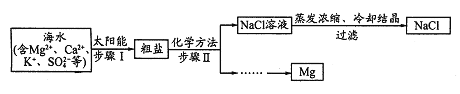
【题目】从海水中提取试剂级NaCl及回收金属Mg的工业流程如图:
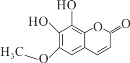
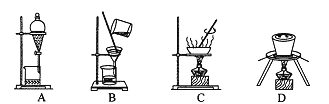
![]() 步骤I原理如图,在实验室中完成该步骤所用装置为 ______
步骤I原理如图,在实验室中完成该步骤所用装置为 ______ ![]() 填序号
填序号![]() 。
。
![]() 某学习小组设计了实验模拟步骤Ⅱ:
某学习小组设计了实验模拟步骤Ⅱ:
粗盐溶解![]() 过滤
过滤![]() NaCl溶液
NaCl溶液
![]() 该实验中加入
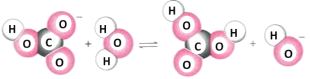
该实验中加入![]() 的作用是 ______ ;若向粗盐溶液中加入的是
的作用是 ______ ;若向粗盐溶液中加入的是![]() 浓溶液,则有难溶的
浓溶液,则有难溶的![]() 生成,同时有气体逸出.该反应的离子方程式为 ______。
生成,同时有气体逸出.该反应的离子方程式为 ______。
![]() 学习小组发现上述实验即使
学习小组发现上述实验即使![]() 用量不足,第
用量不足,第![]() 步沉淀中依然含有少量
步沉淀中依然含有少量![]() ,试从平衡角度分析 ______。
,试从平衡角度分析 ______。
![]() 在第
在第![]() 步后增加过滤,并从滤渣中得到
步后增加过滤,并从滤渣中得到![]() ,工业上通过电解获得Mg的化学方程式为 ______ ; 若
,工业上通过电解获得Mg的化学方程式为 ______ ; 若![]() 时直接将
时直接将![]() 熔融,然后用惰性电极电解,发现有固体剩余,则该固体可能是 ______
熔融,然后用惰性电极电解,发现有固体剩余,则该固体可能是 ______ ![]() 写化学式
写化学式![]() ;现有a g滤渣,用上二述方法处理回收Mg时产生标况下
;现有a g滤渣,用上二述方法处理回收Mg时产生标况下![]() ,剩余固体为c g。则滤渣中镁元素的质量分数为
,剩余固体为c g。则滤渣中镁元素的质量分数为 ![]() 不必化简
不必化简![]() 。
。
【答案】C 除去钙离子、钡离子 ![]() 加入
加入![]() 使
使![]() 的溶解平衡向溶解方向移动,从而形成
的溶解平衡向溶解方向移动,从而形成![]()
![]() 熔融
熔融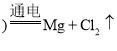 MgO
MgO 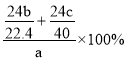
【解析】
由分离流程可知,步骤I利用太阳能进行海水晒盐,与蒸发原理相同,步骤Ⅱ为粗盐溶解![]() 过滤
过滤![]() 溶液,
溶液,![]() 除去硫酸根离子,
除去硫酸根离子,![]() 除去镁离子,
除去镁离子,![]() 除去钙离子及过量的钡离子,最后加盐酸可除去过量的碳酸钠,注意除杂试剂均过量,以此来解答。
除去钙离子及过量的钡离子,最后加盐酸可除去过量的碳酸钠,注意除杂试剂均过量,以此来解答。
(1)步骤I原理为蒸发,在实验室中完成该步骤所用装置为图2中![]() 蒸发
蒸发![]() ;
;
(2)①该实验中加入![]() 的作用是除去钙离子、钡离子;若向粗盐溶液中加入的是
的作用是除去钙离子、钡离子;若向粗盐溶液中加入的是![]() 浓溶液,则有难溶的
浓溶液,则有难溶的![]() 生成,同时有气体逸出,气体为
生成,同时有气体逸出,气体为![]() ,该反应的离子方程式为
,该反应的离子方程式为![]() ;
;
②第③步沉淀中依然含有少量![]() ,是因为加入
,是因为加入![]() 使
使![]() 的溶解平衡向溶解方向移动,从而形成
的溶解平衡向溶解方向移动,从而形成![]() ;
;
![]() 为活泼金属,则工业上通过电解获得Mg的化学方程式为
为活泼金属,则工业上通过电解获得Mg的化学方程式为![]() (熔融)
(熔融)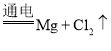 ,
,![]() 时直接将
时直接将![]() 熔融,水解生成
熔融,水解生成![]() ,然后分解生成固体MgO;滤渣中含
,然后分解生成固体MgO;滤渣中含![]() ,产生标况下
,产生标况下![]() b L,由
b L,由![]() (熔融)
(熔融)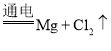 可知含Mg为
可知含Mg为![]() ,剩余固体为c g为MgO的质量,则含Mg为
,剩余固体为c g为MgO的质量,则含Mg为![]() ,则滤渣中镁元素的质量分数为
,则滤渣中镁元素的质量分数为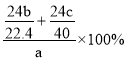 。
。

【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A | B | C | D |
|
|
|
|
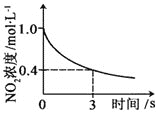
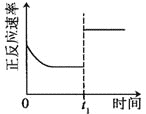
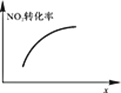
升高温度,正反应方向平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D