题目内容
【题目】Na2CO3与NaHCO3在生产、生活中用途非常广泛,同学们在实验室中探究Na2CO3和NaHCO3的性质。称取Na2CO3、NaHCO3固体各2g,分别加入两支大试管中,再各加10mL蒸馏水,充分溶解后,恢复至室温,各滴入2滴酚酞溶液,观察到如图所示现象。

(1)下列说法中,正确的是_____(填字母序号)。
a.两溶液中所含分子、离子种类完全相同
b.左侧试管中的现象解释了Na2CO3的俗名为什么叫做“纯碱”
c.向两支试管中加入过量硼酸饱和溶液,均有无色气体生成
(2)两溶液中的离子浓度都存在下式的数量关系,请你补充完整:c(Na+)+c(H+)=_____。
(3)NaHCO3溶液中存在下列两种变化趋势:
变化i.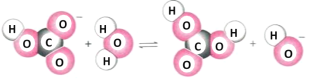
变化ii.(用离子方程式表示)_____。
溶液中滴加酚酞变为粉色,是因为以_____为主(填“变化i”或“变化ii”)。
【答案】ab 2c(CO32-)+c(HCO3-)+c(OH-) HCO3-![]() CO32-+H+ 变化i
CO32-+H+ 变化i
【解析】
质量相同的Na2CO3、NaHCO3加相同量的水,Na2CO3完全溶解,NaHCO3有部分未溶解,说明溶解度:Na2CO3>NaHCO3;
Na2CO3溶液加酚酞变红色,NaHCO3溶液加酚酞变粉色,说明二者都显碱性,且碱性:Na2CO3>NaHCO3,二者显碱性的原因是CO32-和HCO3-都会水解,且水解程度:CO32->HCO3-。
(1)a.Na2CO3溶液存在3个平衡,水解平衡:CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-,水的电离:H2O
H2CO3+OH-,水的电离:H2O![]() H++OH-,所以Na2CO3溶液中含Na+、CO32-、HCO3-、H+、OH-共5种离子,H2O、H2CO3共2种分子。NaHCO3溶液存在3个平衡,水解平衡:HCO3-+H2O
H++OH-,所以Na2CO3溶液中含Na+、CO32-、HCO3-、H+、OH-共5种离子,H2O、H2CO3共2种分子。NaHCO3溶液存在3个平衡,水解平衡:HCO3-+H2O![]() H2CO3+OH-,电离平衡:HCO3-
H2CO3+OH-,电离平衡:HCO3-![]() CO32-+H+、H2O
CO32-+H+、H2O![]() H++OH-,所以NaHCO3溶液中含Na+、CO32-、HCO3-、H+、OH-共5种离子,H2O、H2CO3共2种分子,故a正确;
H++OH-,所以NaHCO3溶液中含Na+、CO32-、HCO3-、H+、OH-共5种离子,H2O、H2CO3共2种分子,故a正确;
b.Na2CO3属于盐,但其水溶液具有较强碱性,所以俗名纯碱,故b正确;
c.酸性:碳酸>硼酸,向两支试管中加入过量硼酸饱和溶液,均不可能产生气体,故c错误;
故答案为:ab;
(2)两溶液中的离子浓度都存在电荷守恒关系:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故答案为:2c(CO32-)+c(HCO3-)+c(OH-);
(3)NaHCO3溶液中存在HCO3-的水解和电离两种趋势,图示为HCO3-的水解,故另一种为电离趋势,其电离方程式为:HCO3-![]() CO32-+H+,滴加酚酞变为粉色,说明NaHCO3溶液显碱性,所以HCO3-的水解程度大于电离程度,即以水解为主,故答案为:HCO3-
CO32-+H+,滴加酚酞变为粉色,说明NaHCO3溶液显碱性,所以HCO3-的水解程度大于电离程度,即以水解为主,故答案为:HCO3-![]() CO32-+H+;变化i。
CO32-+H+;变化i。