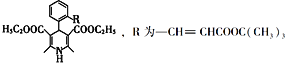题目内容
【题目】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展 的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如图所示:
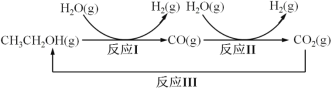
(1)已知:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H1= - 41 kJ/mol
CO2(g)+H2(g) △H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g) ![]() 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
请写出反应 I 的热化学方程式____________。
(2)反应 II,在进气比[n(CO) : n(H2O)]不同时,测得相应的 CO 平衡转化率见图(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。

①经分析,A、E 和 G 三点对应的反应温度相同,其原因是 KA=KE=KG=____________(填数值)。在该温度下:要提高 CO平衡转化率,除了改变进气比之外,还可采取的措施是____________。
② 对比分析 B、E、F 三点,可得出对应的进气比和反应温度的变化趋势之间的关系是____________。
③ 比较 A、B 两点对应的反应速率大小:VA____________VB(填“<” “=”或“>”)。已知反应速率 v=v 正v 逆= k正X(CO)X(H2O)-k逆X(CO2)X(H2),k 正、k 逆分别为正、逆向反应速率常数,X为物质的量分数计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时,![]() =_____________(计算结果保留1位小数)。
=_____________(计算结果保留1位小数)。
(3)反应 III 利用碳酸钾溶液吸收 CO2 得到饱和 KHCO3 电解液,电解活化的 CO2 来制备乙醇。
①已知碳酸的电离常数 Ka1=10-a mol·L1,Ka2=10-b mol·L1,吸收足量 CO2 所得饱和 KHCO3 溶液的 pH=c,则该溶液中lg![]() =________________
=________________
②在饱和 KHCO3 电解液中电解 CO2 来制备乙醇的原理如图所示。则阴极的电极反应式是__________________________。
【答案】CH3CH2OH(g)+H2O(g)![]() 4H2(g)+2CO(g) △H= +256.1 kJ/mol 1 及时移去产物 进气比越大,反应温度越低或进气比越小,反应温度越高 < 36.0 c-a 14CO2+12e-+9H2O=CH3CH2OH+12HCO3-
4H2(g)+2CO(g) △H= +256.1 kJ/mol 1 及时移去产物 进气比越大,反应温度越低或进气比越小,反应温度越高 < 36.0 c-a 14CO2+12e-+9H2O=CH3CH2OH+12HCO3-
【解析】
(1)根据盖斯定律解答;
(2)①CO(g)+H2O(g) ![]() CO2(g)+H2(g)中,平衡常数K=
CO2(g)+H2(g)中,平衡常数K=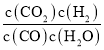 ,根据进气比[n(CO) : n(H2O)]和CO转化率列出“三段式”,计算平衡常数;
,根据进气比[n(CO) : n(H2O)]和CO转化率列出“三段式”,计算平衡常数;
②对比分析 B、E、F 三点,当CO的转化率相同时,温度由低到高对应的进气比为0.5、1、1.5,进气比越高达到相同转化率所需的温度越低;
③A和B两点进气比相等,但A点CO的平衡转化率比B点的大,反应CO(g)+H2O(g)CO2(g)+H2(g) △H1= - 41 kJ/mol是放热反应,温度越高,CO平衡转化率越低,故A的温度小于B的温度;D点达到平衡时,v 正=v 逆,即k正X(CO)X(H2O)=k逆X(CO2)X(H2),D点CO的平衡转换率为60%,进气比为1,设投入CO1mol,H2O1mol,列出“三段式”先计算![]() ,再计算CO平衡转化率为20%时,
,再计算CO平衡转化率为20%时,![]() 的值;
的值;
(3)①根据![]() =
=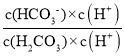 =
=![]() 计算;
计算;
②阴极上CO2得到电子生成CH3CH2OH和碳酸氢根。
(1)反应a.CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H1= - 41 kJ/mol ;b.CH3CH2OH(g)+3H2O(g)
CO2(g)+H2(g) △H1= - 41 kJ/mol ;b.CH3CH2OH(g)+3H2O(g) ![]() 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol;b-2a可得反应 I 的热化学方程式为:CH3CH2OH(g)+H2O(g)
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol;b-2a可得反应 I 的热化学方程式为:CH3CH2OH(g)+H2O(g)![]() 4H2(g)+2CO(g) △H= +256.1 kJ/mol;
4H2(g)+2CO(g) △H= +256.1 kJ/mol;
(2)①CO(g)+H2O(g) ![]() CO2(g)+H2(g)中,平衡常数K=
CO2(g)+H2(g)中,平衡常数K=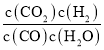 ,根据进气比[n(CO) : n(H2O)]和CO转化率列出“三段式”:
,根据进气比[n(CO) : n(H2O)]和CO转化率列出“三段式”:
E点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量 1 1 0 0
变化量 0.5 0.5 0.5 0.5
平衡量 0.5 0.5 0.5 0.5
K=1
A点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量 1 2 0 0
变化 23 23 23 23
平衡 13 13 13 13
此时K=1
G点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量 3 2 0 0
变化量 1.2 1.2 1.2 1.2
平衡量 1.8 0.8 1. 2 1.2
K=![]() =1,
=1,
故A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的化学平衡常数相同,都等于1;在该温度下:要提高CO平衡转化率,除了改变进气比之外,还可采取的措施是:及时移去产物;
②对比分析 B、E、F 三点,当CO的转化率相同时,温度由低到高对应的进气比为0.5、1、1.5,进气比越高达到相同转化率所需的温度越低,故进气比和反应温度的变化趋势之间的关系是:进气比越大,反应温度越低或进气比越小,反应温度越高;
③A和B两点进气比相等,但A点CO的平衡转化率比B点的大,反应CO(g)+H2O(g)CO2(g)+H2(g) △H1= - 41 kJ/mol是放热反应,温度越高,CO平衡转化率越低,故A的温度小于B的温度,温度越高反应速率越快,故VA<VB;D点达到平衡时,v 正=v 逆,即k正X(CO)X(H2O)=k逆X(CO2)X(H2),D点CO的平衡转换率为60%,进气比为1,设投入CO1mol,H2O1mol,列出“三段式”:
CO(g)+H2O(g)CO2(g)+H2(g)
起始量(mol) 1 1 0 0
变化量(mol) 0.6 0.6 0.6 0.6
平衡量(mol) 0.4 0.4 0.6 0.6
X(CO)=![]() =20%,X(H2O)=
=20%,X(H2O)=![]() =20%,X(CO2)=
=20%,X(CO2)=![]() =30%,X(H2)=
=30%,X(H2)=![]() =30%,
=30%,
代入k正X(CO)X(H2O)=k逆X(CO2)X(H2)得,![]() =
=![]() =
=![]() ;
;
在D点CO的平衡转化率为20%时,列“三段式”
CO(g)+H2O(g)CO2(g)+H2(g)
起始量(mol) 1 1 0 0
变化量(mol) 0.2 0.2 0.2 0.2
平衡量(mol) 0.8 0.8 0.2 0.2
X(CO)=![]() =40%,X(H2O)=
=40%,X(H2O)=![]() =40%,X(CO2)=
=40%,X(CO2)=![]() =10%,X(H2)=
=10%,X(H2)=![]() =10%,
=10%,![]() =
=![]() =
=![]() =36.0;
=36.0;
(3)①![]() =
= =
=![]() ,pH=c,则
,pH=c,则![]() =10-cmol/L,Ka1=10-a mol·L1,
=10-cmol/L,Ka1=10-a mol·L1,![]() =c-a;
=c-a;
②阴极上CO2得到电子生成CH3CH2OH和碳酸氢根,电极方程式为:14CO2+12e-+9H2O=CH3CH2OH+12HCO3-。

【题目】FeSO4 溶液放置在空气中容易变质,因此为了方便使用 Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)26H2O],它比绿矾或绿矾溶液更稳定。(稳定是指物质放置 在空气中不易发生各种化学反应而变质)
I.硫酸亚铁铵晶体的制备与检验
(1)某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都必须煮沸、冷却后再使用,这样处理蒸馏水的目的是_______。向 FeSO4 溶液中加入饱和(NH4)2SO4 溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一 种浅蓝绿色的晶体。
(2)该小组同学继续设计实验证明所制得晶体的成分。
①如图所示实验的目的是_______,C 装置的作用是_______。
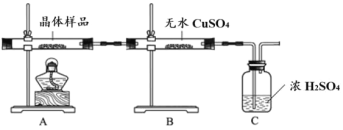
取少量晶体溶于水,得淡绿色待测液。
②取少量待测液,_______ (填操作与现象),证明所制得的晶体中有 Fe2+。
③取少量待测液,经其它实验证明晶体中有NH4+和SO42-
II.实验探究影响溶液中 Fe2+稳定性的因素
(3)配制 0.8 mol/L 的 FeSO4 溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2 溶液(pH=4.0),各取 2 ml 上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分钟后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液;FeSO4溶液则出现淡黄色浑浊。
(资料 1)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释 FeSO4 溶液产生淡黄色浑浊的原因_______。
②讨论影响 Fe2+稳定性的因素,小组同学提出以下 3 种假设:
假设 1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2 溶液中 Fe2+稳定性较好。
假设 2:其它条件相同时,在一定 pH 范围内,溶液 pH 越小 Fe2+稳定性越好。
假设 3:_______。
(4)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分 别控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)为不同的 pH,

观察记录电流计读数,对假设 2 进行实验研究,实验结果如表所示。
序号 | A:0.2mol·L-1NaCl | B:0.1mol·L-1FeSO4 | 电流计读数 |
实验1 | pH=1 | pH=5 | 8.4 |
实验2 | pH=1 | pH=1 | 6.5 |
实验3 | pH=6 | pH=5 | 7.8 |
实验4 | pH=6 | pH=1 | 5.5 |
(资料 2)原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原 电池的电流越大。
(资料 3)常温下,0.1mol/L pH=1 的 FeSO4 溶液比 pH=5 的 FeSO4 溶液稳定性更好。 根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U 型管中左池的电极反应式____________。
②对比实验 1 和 2(或 3 和 4) ,在一定 pH 范围内,可得出的结论为____________。
③对比实验____________和____________,还可得出在一定pH 范围内溶液酸碱性变化对 O2 氧化性强弱的影响因素。
④ 对(资料 3)实验事实的解释为____________。