题目内容
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,据此回答下列问题。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体;
(2)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是__________________________;Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子;
(3)经验规律告诉我们,当成键的两个原子电负性χ的差值Δχ大于1.7时,原子间一般形成的是离子键;Δχ小于1.7时,原子间一般形成的是共价键。已知χ(Fe)=1.8,χ(Cl)=3.1,据此推断化合物FeCl3中Fe-Cl键的共用电子对偏向______原子(填名称),FeCl3属于__________(填“共价化合物”或“离子化合物”);
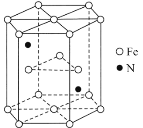
(4)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为a cm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为__________ g/cm3(用代数式表示)。
【答案】X-射线衍射 Cu2O中Cu+的3d轨道处于全满的稳定状态,而CuO中Cu2+的3d轨道排布为3d9,能量高,不稳定 16 氯 共价化合物 ![]()
【解析】
(1)晶体对X-射线发生衍射,非晶体不发生衍射,准晶体介于二者之间;(2)在Cu2O中Cu+原子处于d轨道的全满的稳定状态,而若再失去1个电子变为不稳定状态;计算出该晶胞中O原子数,再由Cu2O中Cu和O的比例判断该晶胞中铜原子数;
(3) 氯原子吸引电子的能力大于铁原子,结合Δχ=χ(Cl) -χ(Fe)=3.1-1.8=1.3<1.7分析解答;
(4)根据均摊法计算晶胞中原子数目,再计算晶胞质量m,和晶胞体积V,根据晶体密度ρ=![]() 计算。
计算。
(1)从外观无法区分晶体、准晶体和非晶体,但用X光照射会发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现象即可确定,故答案为:X-射线衍射;
(2)在Cu2O中Cu+原子的核外电子排布为1s22s22p63s23p63d10,处于d轨道的全满的稳定状态,而若再失去1个电子变为Cu2+时1s22s22p63s23p63d9,是不稳定的状态,CuO在高温时分解为O2和Cu2O;该晶胞中O原子数为4×1+6×![]() +8×
+8×![]() =8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,所以该晶胞中含有Cu原子个数为16个,故答案为:Cu2O中的Cu+3d轨道处于全满的稳定状态,而CuO中Cu2+中3d轨道排布为3d9,能量高,不稳定;16;
=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,所以该晶胞中含有Cu原子个数为16个,故答案为:Cu2O中的Cu+3d轨道处于全满的稳定状态,而CuO中Cu2+中3d轨道排布为3d9,能量高,不稳定;16;
(3) Δχ=χ(Cl) -χ(Fe)=3.1-1.8=1.3<1.7,化合物FeCl3中Fe-Cl键为共价键,FeCl3属于共价化合物,氯原子吸引电子的能力大于铁原子,共用电子对偏向氯原子,故答案为:氯;共价化合物;
(4)图中结构单元底面为正六边形,边长为a cm,底面面积为6×![]() ×a cm×a cm×sin60°=
×a cm×a cm×sin60°=![]() a2cm2;结构单元的体积V=
a2cm2;结构单元的体积V=![]() a2cm2×c cm=
a2cm2×c cm=![]() a2 c cm3,结构单元中含有N原子数为2,含有的Fe原子数为:12×
a2 c cm3,结构单元中含有N原子数为2,含有的Fe原子数为:12×![]() +2×
+2×![]() +3=6,该晶胞的质量m=
+3=6,该晶胞的质量m=![]() =
=![]() g,所以该晶体密度ρ=
g,所以该晶体密度ρ=![]() =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案