题目内容
向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色。根据上述变化过程,分析此三种沉淀物的溶解度关系为( )
| A.AgCl=AgI=Ag2S | B.AgCl<AgI< Ag2S |
| C.AgCl>AgI> Ag2S | D.AgI>AgCI> Ag2S |
C
解析试题分析:向NaCl溶液中滴入AgNO3溶液时发生反应:Ag++Cl-=AgCl↓,出现白色沉淀。由于存在沉淀溶解平衡AgCl(s) Ag+(aq)+Cl-(aq)当向其中一滴KI溶液时,由于c(Ag+)·c(I-)>Ksp(AgI),会产生黄色沉淀:Ag++I-=AgI↓,沉淀由白色变为黄色。由于破坏了沉淀溶解平衡AgCl(s)
Ag+(aq)+Cl-(aq)当向其中一滴KI溶液时,由于c(Ag+)·c(I-)>Ksp(AgI),会产生黄色沉淀:Ag++I-=AgI↓,沉淀由白色变为黄色。由于破坏了沉淀溶解平衡AgCl(s) Ag+(aq)+Cl-(aq)。AgCl会继续溶解电离。直至到达新的平衡状态。发生沉淀转化。同样AgI在溶液中也存在沉淀溶解平衡:AgI(s)
Ag+(aq)+Cl-(aq)。AgCl会继续溶解电离。直至到达新的平衡状态。发生沉淀转化。同样AgI在溶液中也存在沉淀溶解平衡:AgI(s) Ag+(aq)+I-(aq),当再向其中滴加Na2S溶液时,由于c2(Ag+)·c(S2-)>Ksp(Ag2S),会产生黑色沉淀:2Ag++I-= Ag2S↓,沉淀由黄色变为黑色。由于破坏了沉淀溶解平衡AgI(s)
Ag+(aq)+I-(aq),当再向其中滴加Na2S溶液时,由于c2(Ag+)·c(S2-)>Ksp(Ag2S),会产生黑色沉淀:2Ag++I-= Ag2S↓,沉淀由黄色变为黑色。由于破坏了沉淀溶解平衡AgI(s) Ag+(aq)+I-(aq)。AgI会继续溶解电离。直至到达新的平衡状态。发生沉淀转化。直至达到新的平衡状态。最终沉淀又变为黑色。可见物质总是由溶解度大的向溶解度小的转化。则这三种沉淀的溶解度的大小关系为AgCl>AgI> Ag2S 。选项为C.
Ag+(aq)+I-(aq)。AgI会继续溶解电离。直至到达新的平衡状态。发生沉淀转化。直至达到新的平衡状态。最终沉淀又变为黑色。可见物质总是由溶解度大的向溶解度小的转化。则这三种沉淀的溶解度的大小关系为AgCl>AgI> Ag2S 。选项为C.
考点:考查沉淀溶解平衡的知识。

 阅读快车系列答案
阅读快车系列答案下列说法正确的是
| A.向50 mL 1 mol·L-1的盐酸中加入烧碱,水的KW不变 |
| B.NH4Cl和NH3·H2O混合液中,二者对对方的平衡都起了抑制作用 |
| C.有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+) |
D.常温下0.1 mol·L-1的HA溶液中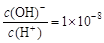 , 则0.01 mol·L-1HA溶液中c(H+)=1×10-4 mol·L-1 , 则0.01 mol·L-1HA溶液中c(H+)=1×10-4 mol·L-1 |
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
| A.c(H+)=c(CHCOO-)+c(OH-) |
| B.加入少量CH3COONa固体后,c(CH3COO—)降低 |
| C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L |
| D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性 |
下列各组数据中,其比值为2∶1的是( )
A.氨水与(NH4)2SO4溶液混合后pH=7的溶液中,[NH ]∶[SO ]∶[SO ] ] |
| B.相同温度下,0.2 mol·L-1乙酸溶液与0.1 mol·L-1乙酸溶液中,[H+]之比 |
C.Na2CO3溶液中,[Na+]∶[CO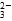 ] ] |
| D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]∶c(KOH) |
溶度积常数表达式符合Ksp=·c(By-)的是( )
A.AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
B.Na2S 2Na++S2- 2Na++S2- |
C.Ag2S(s) 2Ag+(aq)+S2-(aq) 2Ag+(aq)+S2-(aq) |
D.PbI2(s) Pb2+(aq)+2I-(aq) Pb2+(aq)+2I-(aq) |
将0.1 mol下列物质置于1 L水中充分搅拌后,溶液中阴离子数最多的是( )
| A.KCl | B.Mg(OH)2 | C.Na2CO3 | D.MgSO4 |
中和相同体积、相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度的盐酸的体积分别为V1、V2、V3,则三者的大小关系为( )
| A.V3>V2>V1 | B.V3>V2=V1 |
| C.V3=V2>V1 | D.V1=V2>V3 |