题目内容
【题目】在容积不变的密闭容器中存在如下反应:![]()
![]() 。在其他条件不变时,只改变某一个条件,可得到下列图像:
。在其他条件不变时,只改变某一个条件,可得到下列图像:
则下列有关叙述中正确的是![]()
![]()
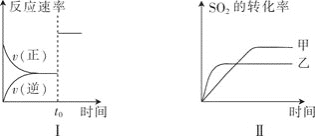
A.图Ⅰ可以表示![]() 时刻增大
时刻增大![]() 的浓度
的浓度
B.图Ⅰ可以表示![]() 时刻加入催化剂
时刻加入催化剂
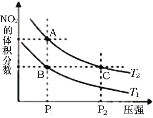
C.图Ⅱ可以表示两种不同压强下![]() 的转化率与时间的关系,且乙的压强比甲高
的转化率与时间的关系,且乙的压强比甲高
D.图Ⅱ可以表示两种不同温度下![]() 的转化率与时间的关系,且甲的温度比乙高
的转化率与时间的关系,且甲的温度比乙高
【答案】B
【解析】
A.由图像可知,![]() 时刻速率增大,但是平衡未移动,则不是增大
时刻速率增大,但是平衡未移动,则不是增大![]() 的浓度,选项A错误;
的浓度,选项A错误;
B.由图像可知,![]() 时刻速率增大,但是平衡未移动,加入催化剂,速率加快,但不影响化学平衡,选项B正确;
时刻速率增大,但是平衡未移动,加入催化剂,速率加快,但不影响化学平衡,选项B正确;
C.若图Ⅱ表示两种不同压强下![]() 的转化率与时间的关系,由“先拐先平数值大”可知,乙的压强大于甲,压强增大,平衡正向移动,应是乙下
的转化率与时间的关系,由“先拐先平数值大”可知,乙的压强大于甲,压强增大,平衡正向移动,应是乙下![]() 的转化率高,与图不符,选项C错误;
的转化率高,与图不符,选项C错误;
D.若图Ⅱ表示两种不同温度下![]() 的转化率与时间的关系,由“先拐先平数值大”可知,乙的温度比甲高,选项D错误;
的转化率与时间的关系,由“先拐先平数值大”可知,乙的温度比甲高,选项D错误;
答案选B。

【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
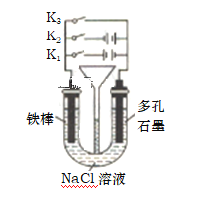
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1