题目内容
【题目】建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是
A. 钠在氧气中燃烧,钠的氧化产物: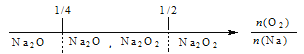
B. 铁在Cl2中燃烧,铁的氧化产物:![]()
C. NH3与Cl2反应,反应产物:
D. FeBr2溶液中通入Cl2,铁元素存在形式:
【答案】C
【解析】
试题A.钠在氧气中燃烧,无论相对量的多少,产生的都是Na2O2,错误;B.铁在Cl2中燃烧,无论相对量的多少,产生的都是FeCl3,错误;C.NH3与Cl2反应,当氨气少量时,发生反应:2NH3+3Cl2=6HCl+N2,当氨气过量时发生的总反应是: NH3+3Cl2=6NH4Cl+N2,若介于2:3和8:3之间则产物是NH4Cl、N2、HCl,正确;D.FeBr2溶液中通入Cl2,由于还原性:Fe2+>Br-,首先发生反应:Cl2+2Fe2+=2Fe3++2Cl-,若氯气过量,则发生反应:2Cl2+2Fe2++4Br-=2Fe3++2Cl-+2Br2,所以上述数轴表示不符合反应的先后顺序,错误。

【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
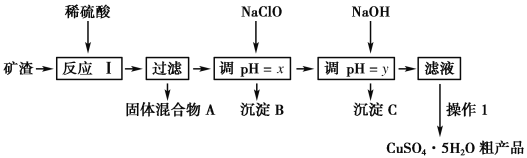
已知:①Cu2O+2H+===Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是____________ (写两条)。
(2)固体混合物A中的成分是________。
(3)反应Ⅰ完成后,铁元素的存在形式为________(填离子符号);写出生成该离子的离子方程式____________。
(4)操作1主要包括:蒸发浓缩、冷却结晶、________。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是______________。
(5)用NaCl0调pH可以生成沉淀B,利用题中所给信息分析沉淀B为_______,该反应的离子方程式为______________.
【题目】反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n待测),其反应包含下列两步:①2NO+H2=N2+H2O2(慢)②H2O2+H2=2H2O(快),T℃时测得有关实验数据如下:
N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n待测),其反应包含下列两步:①2NO+H2=N2+H2O2(慢)②H2O2+H2=2H2O(快),T℃时测得有关实验数据如下:
序号 | c(NO)/molL-1 | c(H2)/molL-1 | 速率/molL-1min-1 |
Ⅰ | 0.0060 | 0.0010 | 1.8×10-4 |
Ⅱ | 0.0060 | 0.0020 | 3.6×10-4 |
Ⅲ | 0.0010 | 0.0060 | 3.0×10-5 |
Ⅳ | 0.0020 | 0.0060 | 1.2×10-4 |
下列说法错误的是
A. 整个反应速度由第①步反应决定
B. 该反应速率表达式:v=5000c2(NO)·c(H2)
C. 正反应的活化能:①<②
D. 该反应的热化学方程式为2NO(g)+2H2(g)═N2(g)+2H2O(g) △H=-664kJmol-1
【题目】下列物质性质与用途的对应关系不正确的是( )
选项 | 性质 | 用途 |
A. | 次氯酸有强氧化性 | 用作漂白剂 |
B. | 氢氧化铝能与酸反应 | 用作抗酸药 |
C. | 明矾易溶于水 | 可作净水剂 |
D. | 硫酸有酸性 | 用于金属加工前的酸洗 |
A. A B. B C. C D. D