题目内容
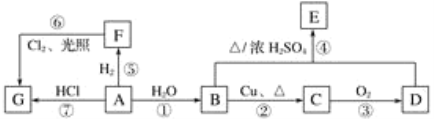
【题目】NaCl是一种化工原料,可以制备一系列物质,如图所示。
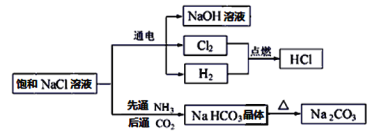
请回答下列问题:
(1)上述流程框图中属于电解质且存在熔融态导电的是________,属于非电解质的是_______。
(2)H2和Cl2的反应属于______________________(填字母。
A.化合反应 b.离子反应 c.氧化还原反应
(3)电解饱和NaCl溶液的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
(4)Na2CO3溶液中通入少量HCl,发生反应的离子方程式为_______________________。
【答案】Na2CO3 NH3、CO2 ac Cl2 4.48 CO32-+H+=HCO3-
【解析】
(1)电解质是在水溶液中或在熔融状态下就能够导电(自身电离成阳离子与阴离子)的化合物,非电解质是在水溶液中和在熔融状态下都不导电的化合物;
(2)化合反应特点为多变一,有化合价变化的为氧化还原反应;
(3)根据氧化还原反应的规律,还原剂对应的产物为氧化产物;对于![]() 。每生成2mol气体,转移电子数为2mol,据此来计算;
。每生成2mol气体,转移电子数为2mol,据此来计算;
(4)Na2CO3溶液中通入少量HCl,生成碳酸氢钠和氯化钠。
(1)饱和NaCl溶液、NaOH溶液属于混合物,Cl2、H2属于单质,HCl属于电解质但熔融状态不发生电离不导电,NH3、CO2属于非电解质,NaHCO3晶体属于电解质但受热易分解无熔融态,Na2CO3属于电解质熔融态能导电,故答案为:Na2CO3;NH3、CO2;
(2)反应![]() 属于化合反应,氧化还原反应,故答案为ac;
属于化合反应,氧化还原反应,故答案为ac;
(3)对于![]() Cl-失去电子发生氧化反应生成氧化产物Cl2。每生成2mol气体,转移电子数为2mol,则每转移0.2mol电子,共产生标准状况下气体的总体积是V=nVm=4.48L;故答案为Cl2;4.48;
Cl-失去电子发生氧化反应生成氧化产物Cl2。每生成2mol气体,转移电子数为2mol,则每转移0.2mol电子,共产生标准状况下气体的总体积是V=nVm=4.48L;故答案为Cl2;4.48;
(4)Na2CO3溶液中通入少量HCl,生成碳酸氢钠和氯化钠CO32-+H+=HCO3-,故答案为:CO32-+H+=HCO3-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案