题目内容
【题目】常温下,用0.1mol·L-1HCl溶液滴定0.1mol·L-1 NH3·H2O溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列说法不正确的是
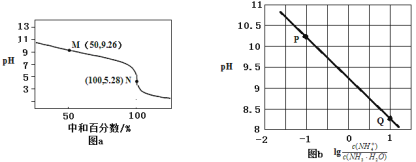
A.Kb(NH3·H2O)的数量级为10-5
B.P到Q过程中,水的电离程度逐渐增大
C.当滴定至溶液呈中性时,c(NH4+)>c(NH3·H2O)
D.N点,c(Cl- ) - c(NH4+)=![]()
【答案】D
【解析】
A. 在M点反应了50%,此时![]() , pH = 9.26,
, pH = 9.26,![]() ,因此Kb(NH3·H2O)数量级为105,故A正确;
,因此Kb(NH3·H2O)数量级为105,故A正确;
B. P到Q过程中是盐酸不断滴加到氨水中,氨水不断被消耗,碱性不断减弱,因此水的电离程度逐渐增大,故B正确;
C. 当滴定至溶液呈中性时,pH = 7,根据![]() ,得出
,得出![]() ,
,![]() ,则c(NH4+)>c(NH3·H2O),故C正确;
,则c(NH4+)>c(NH3·H2O),故C正确;
D. N点,根据电荷守恒得到,c(Cl-) c(NH4+)= c(H+) c(OH-)=1×105.28 ![]() ,故D错误。
,故D错误。
综上所述,答案为D。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目