题目内容
【题目】2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能
有效抑制新型冠状病毒(2019-nCoV)的感染。
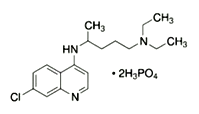
(1)已知磷酸氯喹的结构如图所示,则所含C、N、O三种元素第一电离能由大到小的顺序为_______________。P原子核外价层电子排布式为________,其核外电子有____个空间运动状态。
(2)磷酸氯喹中N原子的杂化方式为_________,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是_______________________。
(3)H3PO4中PO43- 的空间构型为________________。
(4)磷化镓是一种由ⅢA族元素镓(Ga)与VA族元素磷(P)人工合成的Ⅲ—V族化合物半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。
①磷化镓晶体中含有的化学键类型为__________(填选项字母)
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,则原子2的分数坐标为______________。

③若磷化镓的晶体密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___________pm。
【答案】N > O > C 3s23p3 9 sp2、sp3 NH3存在分子间氢键,分子间氢键影响沸点,使得沸点高 正四面体形 BCE (0.25,0.75,0.25) 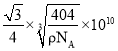
【解析】
(1)同周期第一电离能有增大的趋势,但有特殊;先写出P电子排布式,一种空间运动状态对应着一种空间伸展方向,即轨道。
(2)分析不同氮原子的价层电子对数,NH3沸点比AsH3的沸点高主要是NH3存在分子间氢键。
(3)计算PO43中价层电子对数。
(4)①金刚石中每个碳与周围四个碳原子形成4个碳碳键,同理每个P与4个Ga以单键相连,每个Ga与4个P单键相连,而P最外层有5个电子,Ga最外层有3个电子,只能形成三对共用电子对,它们之间有4个共价键,因此有一个配位键,P与Ga之间存在的单键是极性共价键,是σ键;②若沿y轴投影的晶胞中所有原子的分布图如图,则原子2为P原子,P原子是与下面面心,后面面心,左侧面心和左后顶点相连;③先计算晶胞中P、Ga原子数,再计算体积,再计算晶胞边长,再计算Ga和P原子的最近距离。
(1)同周期第一电离能有增大的趋势,但有特殊,依次C、N、O三种元素第一电离能由大到小的顺序为N > O > C;P电子排布式为1s22s22p63s23p3,其原子核外价层电子排布式为3s23p3,一个轨道为一种空间运动状态,因此P其核外电子有9个空间运动状态;故答案为:N > O > C;3s23p3;9。
(2)磷酸氯喹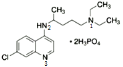 ,图中1、2号N原子价层电子对数为
,图中1、2号N原子价层电子对数为![]() ,杂化方式为sp3,3号N原子层电子对数为2+1 =3,杂化方式为sp2,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是NH3存在分子间氢键,分子间氢键影响沸点,因此NH3沸点比AsH3的沸点高;故答案为:sp2、sp3;NH3存在分子间氢键,分子间氢键影响沸点,因此NH3沸点比AsH3的沸点高。
,杂化方式为sp3,3号N原子层电子对数为2+1 =3,杂化方式为sp2,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是NH3存在分子间氢键,分子间氢键影响沸点,因此NH3沸点比AsH3的沸点高;故答案为:sp2、sp3;NH3存在分子间氢键,分子间氢键影响沸点,因此NH3沸点比AsH3的沸点高。
(3)H3PO4中PO43中价层电子对数为![]() ,因此空间构型为正四面体形;故答案为:正四面体形。
,因此空间构型为正四面体形;故答案为:正四面体形。
(4) ①金刚石中每个碳与周围四个碳原子形成4个碳碳键,同理每个P与4个Ga以单键相连,每个Ga与4个P单键相连,而P最外层有5个电子,Ga最外层有3个电子,只能形成三对共用电子对,它们之间有4个共价键,因此有一个配位键,P与Ga之间存在的单键是极性共价键,是σ键,所有磷化镓晶体中含有的化学键类型为BCE;故答案为:BCE。
②若沿y轴投影的晶胞中所有原子的分布图如图,则原子2为P原子,P原子是与下面面心,后面面心,左侧面心和左后顶点相连,其分数坐标为(0.25,0.75,0.25);故答案为:(0.25,0.75,0.25)。
③根据晶胞结构得到P有4个,Ga有![]() ,若磷化镓的晶体密度为ρ g·cm-3,阿伏加德罗常数的值为NA,
,若磷化镓的晶体密度为ρ g·cm-3,阿伏加德罗常数的值为NA,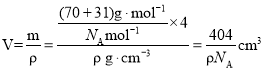 ,则晶胞边长为
,则晶胞边长为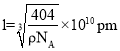 ,则晶胞中Ga和P原子的最近距离为晶胞体对角线的四分之一,因此
,则晶胞中Ga和P原子的最近距离为晶胞体对角线的四分之一,因此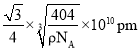 ;
;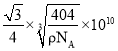 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案