题目内容
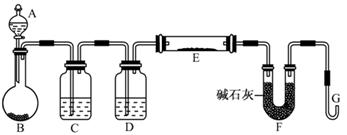
某同学欲在实验室中完成Fe与水蒸气反应的实验,装置如图甲、乙两种。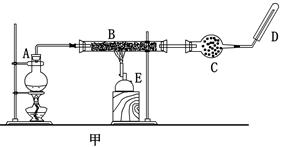
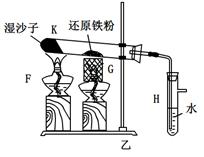
已知:B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒
精灯。对比两装置,回答下列问题:
(1)如何检查乙装置的气密性: 。
(2)乙装置中湿沙子的作用是: 。
(3)B处发生反应的化学方程式: 。
(4)称取mg铁粉与适量石棉绒混合,然后加热至无气体放出。若收集的气体体积换算为标准状况为VL,铁粉的转化率为 (列出计算式即可,不必化简)。
(5)为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入一定量的盐酸使固体混合物溶解,过滤,立即向滤液中滴加KSCN溶液,结果观察到溶液的颜色没变化。经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe。他的理由是: _。
(1)向H中加入水没过导管口,连接好装置,微热K,若H中导管口出现气泡,停止加热后导管中出现水柱,证明气密性良好(2分,其他合理答案也给分)
(2)提供水蒸气(1分) (3)3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
(4) ×
× ×56×
×56× ×100%(1分)(注:化简后且正确的代数式均可,如
×100%(1分)(注:化简后且正确的代数式均可,如 ×100% 或
×100% 或 )
)
(5)铁粉可能有剩余,剩余铁粉会与Fe3+反应,将Fe3+溶液中完全还原为Fe2+。(1分)
解析试题分析:(1)装置气密性的检验一般采用“注水发”,因此根据乙装置的特点可知,检验乙装置的实验操作是向H中加入水没过导管口,连接好装置,微热K,若H中导管口出现气泡,停止加热后导管中出现水柱,证明气密性良好。
(2)铁再高温下与水蒸气反应小于提供反应物水蒸气,所以湿沙子的作用是提供水蒸气。
(3)高温下铁与水蒸气反应生成四氧化三铁和氢气,因此B处发生反应的化学方程式为3Fe+4H2O Fe3O4+4H2。
Fe3O4+4H2。
(4)标准状况下氢气的体积是VL,则氢气的物质的量是 mol,所以根据反应式3Fe+4H2O
mol,所以根据反应式3Fe+4H2O Fe3O4+4H2可知,参加反应的铁的物质的量是
Fe3O4+4H2可知,参加反应的铁的物质的量是 ×
× mol,其质量是
mol,其质量是 ×
× mol×56g/mol,所以铁粉的转化率为
mol×56g/mol,所以铁粉的转化率为 ×
× ×56×
×56× ×100%。
×100%。
(5)因为再反应中铁粉可能有剩余,剩余铁粉会与Fe3+反应,将溶液中Fe3+完全还原为Fe2+,所以向滤液中滴加KSCN溶液,未观察到溶液的颜色没变化。
考点:考查铁与水蒸气反应原理的实验探究、转化率的有关计算以及铁离子的检验等

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
【实验设计】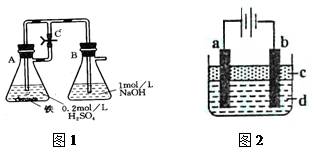
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有: 。
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:①纯水 ②NaCl溶液 ③NaOH溶液 ④四氯化碳 ⑤CuCl2溶液 ⑥乙醇 ⑦Fe棒 ⑧植物油 ⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
【探究思考】
实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色 Fe(OH)3。这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+。 |
阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:__________ ;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________。
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。
某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。 
(1)能说明有SO2气体产生的实验现象是 。
(2)图2中导气管e的主要作用为 。
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:
。
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是 。
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+; Ⅲ:既有Fe3+又有Fe2+。
为确认溶液的成分,选用如下试剂:
| A.稀HCl溶液 | B.稀硫酸 | C.KSCN溶液 | D.酸性KMnO4溶液 |
试完成下列相关的实验探究:
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1) ,则说明Ⅱ成立。 (2) ,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立。 |
| 2、 | 。 |
Fe2O3具有广泛的用途。
甲同学阅读有关资料得知:在高温下煅烧FeCO3 可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
| 实验步骤 | 实验操作 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温。 |
| Ⅱ | 取少量实验步骤Ⅰ所得固体放于一洁净的试管中,用足量的稀硫酸溶解。 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红。 |
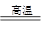 2Fe2O3+4CO2
2Fe2O3+4CO2(1)写出实验步骤Ⅲ中发生反应的离子方程式 。
(2)乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+。于是乙同学对甲同学的实验步骤Ⅲ进行了补充改进:检验实验步骤Ⅱ所得溶液中是否含有Fe2+。他需要选择的试剂是__________(填序号)。
a.氯水 b.氯水+KSCN溶液 c. K3[Fe(CN)6](铁氰化钾溶液)
(3)丙同学认为即使得到了乙同学预期的实验现象,也不能确定煅烧产物的成分。你认为丙同学持此看法的理由是 。
(4)丙同学进一步查阅资料得知,煅烧FeCO3的产物中,的确含有+2价铁元素。于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:
稀硫酸、 (填名称)和 (填名称);再____________(填操作名称),灼烧,即可得到Fe2O3
(5)工业上通过控制样品的质量,使滴定时消耗KMnO4溶液体积数为c mL,菱铁矿中FeCO3的质量分数为c%,可以简化测量。
某同学取含FeCO3 c%的菱铁矿a g,用足量稀硫酸溶解后,再用0.0200mol·L-1的酸性KMnO4溶液滴定(KMnO4被还原成Mn2+),最终消耗KMnO4溶液c mL。假定矿石中无其他还原性物质,则所取菱铁矿的质 量a="_____________" g。(FeCO3的摩尔质量为116 g·mol-1)
古代器物上的颜料至今尚没有发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确的是
| A.用盐的形式表示: BaSiO3·CuSiO3 | B.用氧化物形式表示:BaO·CuO·2SiO2 |
| C.易溶于强酸、强碱 | D.性质稳定,不易褪色 |
 测定剩余固体质量
测定剩余固体质量 测定沉淀质量
测定沉淀质量 测定生成二氧化碳的质量
测定生成二氧化碳的质量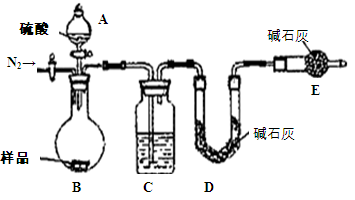

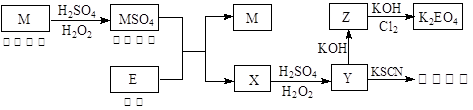
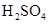 和
和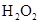 混合液的离子方程式: 。
混合液的离子方程式: 。