题目内容
某兴趣小组为测定某工业纯碱(假设仅含NaHCO3杂质)中Na2CO3的质量分数,设计了下列四种实验方案:
方案一:纯碱样品 测定剩余固体质量
测定剩余固体质量
(1)称取mg样品放入坩埚中充分加热。坩埚中发生反应的化学方程式为:
(2)将坩埚置于干燥器中冷却后称量。实验时需要重复“加热、冷却、称量”操作多次,其目的是: 。
方案二:称取mg样品配成250mL溶液,从中取25mL溶液先用酚酞作指示剂用0.1mol/LHCl溶液滴定至终点,消耗0.1mol/LHCl溶液V1mL,继续用甲基橙作指示剂滴定至终点,消耗0.1mol/LHCl溶液V2mL。则该样品中碳酸钠的质量分数为: 。
方案三:纯碱样品溶液 测定沉淀质量
测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解后滴加足量氯化钙溶液。将反应混和物过滤后的下一步操作是: ,沉淀经干燥后称量为m2g。
(2)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,_______测定样品中的Na2CO3的质量分数。(填“能”或“不能”)
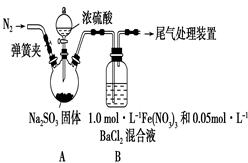
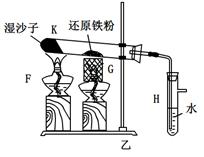
方案四:纯碱样品 测定生成二氧化碳的质量
测定生成二氧化碳的质量
(1)本实验采用如图装置,C中盛放的物质是 。
(2)反应前后都要通入N2,反应后通入N2的目的是: 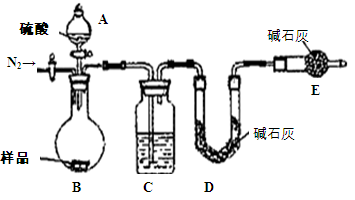
方案一:(1)2NaHCO3=Na2CO3+CO2↑+H2O
(2)加热至恒重,以保证NaHCO3全部分解
方案二: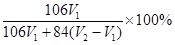 或
或 (3分)
(3分)
方案三:(1)洗涤沉淀 (2)能
方案四:(1)浓硫酸 (2)将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收
解析试题分析:方案一:该方案原理为:在加热条件下Na2CO3能够稳定存在,而NaHCO3易发生分解反应,从而根据残留的固体的量推算出样品中碳酸钠的质量分数;(1)坩埚中发生反应的化学方程式为:2NaHCO3 Na2CO3 + CO2↑+ H2O;(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解;
Na2CO3 + CO2↑+ H2O;(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解;
方案二:该实验方案的原理为用双指示剂法测定Na2CO3和NaHCO3的混合物中Na2CO3的质量分数,以酚酞作指示剂,发生的反应为Na2CO3+HCl=NaHCO3+NaCl,再以甲基橙作指示剂,发生的反应为NaHCO3+HCl=NaCl+H2O+CO2↑,根据上述原理,以酚酞作指示剂,发生的反应为Na2CO3+HCl=NaHCO3+NaCl,n(Na2CO3)="n(HCl)=" 10×0.1mol/L×0.001V1L="0.001" V1 mol,m(Na2CO3)="0.106" V1g,碳酸钠的质量分数为0.106 V1g/mg×100%="10.6" V1/m%;
方案三:该实验方案的原理为:纯碱样品中的碳酸钠与氯化钙溶液反应生成碳酸钙沉淀和水,通过测定碳酸钙的质量来确定碳酸钠的质量分数;(1)碳酸钙沉淀会附着氯化钠、氯化钙等杂质,过滤后需用蒸馏水洗涤沉淀;(2)在一定量样品中加入足量Ca(OH)2溶液分别发生如下反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,均产生CaCO3沉淀,根据样品的总质量和生成CaCO3沉淀的量,可以计算碳酸钠质量,能测得碳酸钠的质量分数;
方案四:该实验方案的原理为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,
2NaHCO3+ H2SO4= Na2SO4+H2O+CO2↑,通过准确测定样品的质量和二氧化碳的质量,来计算碳酸钠的质量分数;(1)该反应产生的二氧化碳中含有水蒸气,会影响二氧化碳质量的测定,必须除去,故C装置的作用为干燥二氧化碳,盛放的物质是浓硫酸;(2)该方案关键是要准确测量产生的CO2的质量,实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被D中碱石灰完全吸收,导致测定结果有较大误差,所以反应前后都要通入N2,反应后通入N2的目的是:将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收。
考点:以实验探究“工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数”为载体,考查化学实验原理与装置评价、实验基本操作、化学计算等。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因。
[分析与猜想]
(1)根据过氧化钠与水反应的原理:2Na2O2 + 2H2O =" 4NaOH" + O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会退色,而实验中发现酚酞变红后又退色。由此提出如下的猜想:
A.氧气有漂白性
B.氢氧化钠有漂白性
C.
[实验与判断] 请完成下列表格:
| 实验编号 | 1 | 2 | 3 |
| 实验装置 | 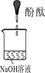 | 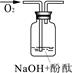 | 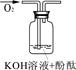 |
| 验证猜想 | | C | |
| 实验现象 | 溶液变红后不退色 | ||
| 实验说明 | 1、2的实验中NaOH溶液是用 (填“氢氧化钠固体”、“氧化钠固体”、“过氧化钠固体”)溶于水配制的。 | ||
(2)根据以上实验分析发现:过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不很稳定、具有漂白性的物质X,X的化学式是 。
(3)可用右图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是 (填选项,下同),②处装入的物质是 。
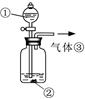
A.酚酞试剂 B.过氧化钠与水反应后的溶液
C.二氧化锰 D.氢氧化钠固体配制的溶液
(4)气体③是 ,过氧化钠与水反应的化学方程式没有写出X来,原因是 。
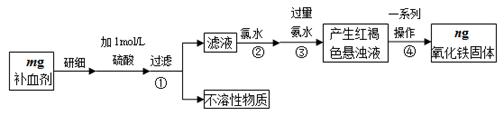
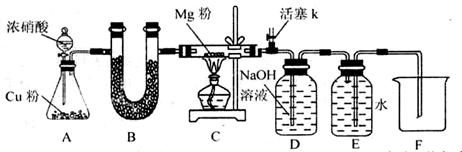
铁铜单质及其化合物的应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯: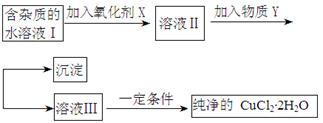
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂的目的是
(2)下列最适合作氧化剂X的是
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是
(4)如果不用物质Y而直接用可溶性碱溶液能不能达到目的? (填“能”或者“不能”)。若不能,试解释原因 (若填“能”,此空不用回答)
(5)最后能不能直接蒸发得到CuCl2·2H2O? (填“能”或者“不能”)。若不能,应该如何操作才能得到CuCl2·2H2O (若填“能”,此空不用回答)
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是
(7)若向溶液Ⅱ中加入镁粉,产生的气体是 ,试解释原因
(8)FeCl3溶液具有净水作用的原因是