题目内容
20.下列关于如图所示原电池装置的叙述中,正确的是( )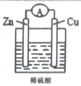
| A. | 每当Zn片质量减少65克,Cu片会产生22.4L气体 | |
| B. | 溶液的pH逐渐减小 | |
| C. | 电子从锌片经导线流向铜片 | |
| D. | 氢离子在铜片表面被氧化 |
分析 该原电池装置中,锌易失电子作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极.
解答 解:A.未指明标准状态,则无法计算产生的气体体积,故A错误;
B.正极上氢离子得电子发生还原反应,所以pH逐渐增大,故B错误;
C.电子从负极锌沿导线流向正极铜,故C正确;
D.该装置中锌易失电子作负极,铜作正极,正极上氢离子在铜片表面得电子发生还原反应被还原,故D错误;
故选C.
点评 本题考查了原电池原理,根据电极上得失电子判断正负极,再结合电极反应类型、电子流向来分析解答,熟记原电池原理,难点是电极反应式的书写.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
10.如图是铜锌原电池装置,下列有关叙述错误的是( )
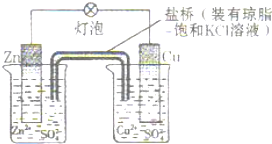

| A. | 负极反应为:Zn-2e-═Zn2+ | B. | 电池反应为:Zn+2H+═Zn2++H2↑ | ||
| C. | 在外电路中,电子从负极流向正极 | D. | 盐桥中的K+移向CuSO4溶液 |
11.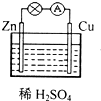 对于Zn、Cu和稀H2SO4组成的原电池(如图),下列有关说法正确的是( )
对于Zn、Cu和稀H2SO4组成的原电池(如图),下列有关说法正确的是( )
 对于Zn、Cu和稀H2SO4组成的原电池(如图),下列有关说法正确的是( )
对于Zn、Cu和稀H2SO4组成的原电池(如图),下列有关说法正确的是( )| A. | Cu是负极 | B. | 在外电路中,电流由Zn流向Cu | ||
| C. | Zn电极上发生氧化反应 | D. | Cu极反应:Cu2++2e-═Cu |
8.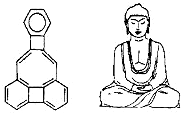 美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子(所有原子在同一平面),有关该有机分子的说法正确的是( )
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子(所有原子在同一平面),有关该有机分子的说法正确的是( )
 美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子(所有原子在同一平面),有关该有机分子的说法正确的是( )
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子(所有原子在同一平面),有关该有机分子的说法正确的是( )| A. | 该有机物属于烃的衍生物 | B. | 该有机物属于苯的同系物 | ||
| C. | 该有机物分子中含有22个碳原子 | D. | 该有机物一氯代物只有4种 |
5.下列描述中正确的是( )
| A. | ClO2-的空间构型为平面三角形 | |
| B. | SiF4和SO32-的中心原子均为sp3杂化 | |
| C. | 在所有的元素中,氟的第一电离能最大 | |
| D. | C2H5OH分子中共含有8个极性键,1个π键 |
9.下列有关丙酸的说法不正确的是( )
| A. | 丙酸遇紫色石蕊试剂变红 | B. | 丙酸与乙醇的酯化反应是取代反应 | ||
| C. | 丙酸和乙酸属于同一类物质 | D. | 丙酸可以和乙烯一样发生加成反应 |
20.向一恒容密闭容器中充入2mol A气体和1mol B气体,在一定条件下发生反应:2A+B$\stackrel{催化剂}{?}$2C,生成C气体,下列有关说法正确的是( )
| A. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| B. | 当C、B、A的分子数比为2:1:2,反应达到平衡状态当 | |
| C. | 当单位时间消耗a mol B,同时消耗2a molA时,反应达到平衡状态 | |
| D. | B的气体的分压强不变时,反应达到平衡状态 |
 图是X、Y、Z三种物质的溶解度曲线,
图是X、Y、Z三种物质的溶解度曲线,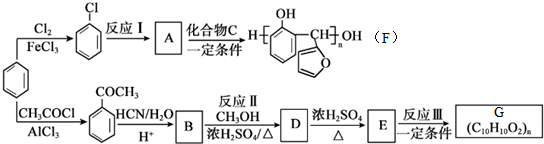
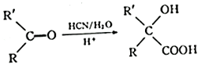
 生成
生成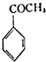 的反应类型是取代反应.
的反应类型是取代反应.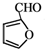 、
、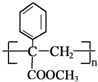 .
. .
.