题目内容
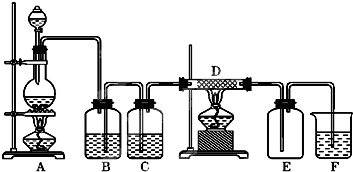
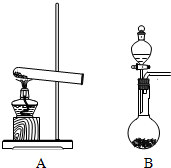
实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
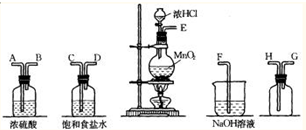
(1)连接上述仪器的正确顺序是(填各接口处的字母):______接______,______接______,______接______,______接______.
(2)在装置中:①饱和食盐水起的作用是______浓硫酸起的作用是______.

(1)连接上述仪器的正确顺序是(填各接口处的字母):______接______,______接______,______接______,______接______.
(2)在装置中:①饱和食盐水起的作用是______浓硫酸起的作用是______.
(1)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;因为收集的是气体,所以除杂装置中长导管进气,段导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接饱和食盐水装置后连接浓硫酸装置;收集装置中,因为氯气的浓度大于空气的,所以长导管进气短导管出气.
故答案为:E-C,D-A,B-H,G-F;
(2)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度;浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气.
故答案为:除去挥发出的HCl气体,抑制C12在水中的溶解;吸收水蒸气,干燥Cl2;
故答案为:E-C,D-A,B-H,G-F;
(2)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度;浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气.
故答案为:除去挥发出的HCl气体,抑制C12在水中的溶解;吸收水蒸气,干燥Cl2;

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目