题目内容
9.下列说法正确的是( )| A. | 若完全燃烧,1 mol雌酮(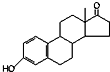 )比雄酮( )比雄酮(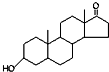 )多消耗3 mol O2 )多消耗3 mol O2 | |
| B. | 正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 | |
| C. | 甲醛、甲酸、甲酸钠,均能发生银镜反应 | |
| D. | 乙醇依次通过消去、取代、加成反应可生成乙二醇 |
分析 A.对比雄酮和雌酮的结构找出碳氢原子数的多少;
B.同分异构体中,支链越多,沸点越低;
C.含醛基的物质能发生银镜反应;
D.乙醇消去得到乙烯,乙烯和氯气加成得到1,2-二氯乙烷,1,2-二氯乙烷水解得到乙二醇.
解答 解:A.一个雄酮分子比一个雌酮分子多1个C、8个H,完全燃烧产物为二氧化碳、水,1个C、4个H需要消耗3个O2,因此1mol雄酮比雌酮多消耗3mol O2,故A错误;
B.根据同分异构体沸点变化规律为支链越多沸点越低,正戊烷、异戊烷和新戊烷支链依次增多,故沸点依次降低,故B错误;
C.甲醛、甲酸、甲酸钠都含有醛基,能发生银镜反应,故C正确;
D.乙醇消去得到乙烯,乙烯和氯气加成得到1,2-二氯乙烷,1,2-二氯乙烷水解(取代)得到乙二醇,故D错误;
故选C.
点评 本题考查了有机物结构与性质、有机反应的综合应用,题目难度中等,注意掌握常见有机物的组成、结构及具有的化学性质,选项A为易错点,注意分子式判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 4.0 g重水(D2O)中所含质子数为0.4NA | |
| B. | 4.48 L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 6.2 g白磷与红磷的混合物中所含磷原子数为0.2NA | |
| D. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
17.通常是用加热分解的方法冶炼的金属是( )
| A. | Na | B. | Mg | C. | Ag | D. | Fe |
14.下列物质中既能脱水生成烯烃又能催化氧化生成醛的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
18.对于同一周期从左到右的主族元素,下列说法中,正确的是( )
| A. | 原子半径逐渐增大 | B. | 原子的得电子能力逐渐减弱 | ||
| C. | 最高正化合价逐渐减小 | D. | 元素的金属性逐渐减弱 |
19.判断下列各组物质,互为同系物的是( )
| A. | C2H6和C4H10 | B. | C3H8和C5H10 | C. | C6H6和C6H12 | D. | CH4和C2H2 |


