题目内容
19.X、Y两元素可形成X2Y3型化合物,则X、Y原子最外层的电子排布可能是( )| A. | X:3s23P1 Y:3s23P5 | B. | X:2s22P3Y:2s22P4 | ||
| C. | X:3s23P2 Y:3s23P3 | D. | X:3s2 Y:2s22P3 |
分析 X、Y两元素可形成X2Y3型化合物,可判断X的可能化合价为+3价,Y的可能化合价为-2价,判断最外层电子,并结合选项判断元素,根据元素形成的化合物判断.
解答 解:X、Y两元素可形成X2Y3型化合物,可判断X的可能化合价为+3价,Y的可能化合价为-2价,
A.X的最外层的电子排布3s23p1,X为Al元素,Y的最外层的电子排布3s23p5,Y为Cl元素,组成的化学为AlCl3,故A错误;
B.X的电子排布为2s22p3时,为N元素,Y的最外层的电子排布2s22p4为O元素,可形成N2O3,故B正确;
C.X的电子排布为3s23p2时,为Si元素,Y的最外层的电子排布3s23p3为P元素,硅没有+3价,二者不能形成X2Y3型化合物,故C错误;
D.X的最外层的电子排布3s2X为Mg元素,Y的最外层的电子排布2s22p3,Y为N元素,形成化合物为X3Y2,不符合题意,故D错误.
故选B.
点评 本题考查原子核外电子排布,题目难度不大,注意根据化合物的类型判断可能的化合价,由此推断可能的核外电子排布.

练习册系列答案
相关题目
14.下列各反应的离子方程式中,错误的是( )
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 将铝片放入过量NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-═2AlO2-+H2O |
4.下列关于氢元素的叙述中,错误的是( )
| A. | 自然界中有11H、12H、13H三种氢的同位素,它们的化学性质不相同 | |
| B. | ${\;}_{1}^{1}$H失去1个电子后,变成1个质子 | |
| C. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是三种不同的原子 | |
| D. | 11H、21H、31H在化学反应中容易失去一个电子而显+1价 |
8.下列说法不正确的是( )
| A. | 烃是指仅含碳和氢两种元素的有机物 | |
| B. | 含碳化合物都属有机物 | |
| C. | 分子里含有苯环的碳氢化合物属于芳香烃 | |
| D. | 通常所说的“白色污染”是指聚乙烯等白色塑料垃圾 |
 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
 如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则:
如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则: ,C的离子结构示意图:
,C的离子结构示意图:
 .
. ;
; ,工业合成路线如下:
,工业合成路线如下:

 (R-代表烃基)
(R-代表烃基) 、
、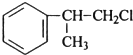 ;
;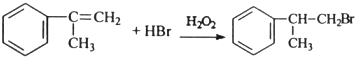 ;
; .
.