题目内容
【题目】某废催化剂含ZnO、ZnS、CuS和SiO2及少量的Fe3O4。
I.某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

回答下列问题:
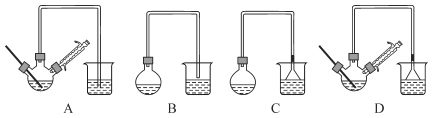
(1)在下图装置中,第一次浸出反应装置最合理的是____(填标号)。步骤①中发生的化学反应为非氧化还原反应,最好在(填设备名称)____中进行。
(2)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法为(提供的试剂:K3[Fe(CN)6]溶液、稀盐酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水)____。
(3)步骤③中发生反应的离子方程式为____;向盛有滤渣1的反应器中加入稀硫酸和过氧化氢溶液,应先加____,若顺序相反,会造成____。
(4)步骤②、④中,获得晶体的实验操作方法是____,过滤。
Ⅱ.另一同学也以该废催化剂为原料,采用下列实验操作方法也得到了ZnSO4。
![]()
(5)若一次水解时,产物为Zn( OH)xCly。取一次水解产物10. 64 g,经二次水解、干燥,得到9.9 g的Zn(OH)2(假设各步均转化完全),则一次水解产物的化学式为_______ .
【答案】C 通风橱 取少量滤液1,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀,则证明有Fe2+(或滴加KMnO4溶液,若褪色则证明有Fe2+) CuS+H2O2+2H+![]() Cu2++S+2H2O 稀硫酸 H2O2与固体颗粒接触分解 蒸发浓缩、冷却结晶 Zn(OH)1.6Cl0.4
Cu2++S+2H2O 稀硫酸 H2O2与固体颗粒接触分解 蒸发浓缩、冷却结晶 Zn(OH)1.6Cl0.4
【解析】
废催化剂中含ZnO、ZnS、CuS、SiO2、Fe3O4,加入硫酸,ZnO、ZnS、Fe3O4与稀硫酸反应,滤液1中含有Zn2+、Fe2+、Fe3+,CuS、SiO2不与稀硫酸发生反应,即滤渣1中有SiO2、CuS,滤渣1中加入稀硫酸和H2O2加热浸出CuSO4;然后逐项进行分析;
(1)①中发生ZnO+H2SO4=ZnSO4+H2O、ZnS+H2SO4=ZnSO4+H2S↑、Fe3O4+8H+=Fe2++2Fe3++4H2O,这些反应不需要加热,因此反应装置中不需要温度计,H2S有毒,能溶于水,尾气处理时,需要防止倒吸,即C装置最合理;发生反应时,产生H2S气体,H2S气体有毒,且易燃,需要在通风厨中进行;
(2)根据(1)的分析,滤液1中含有Zn2+、Fe2+、Fe3+,检验Fe2+用K3[Fe(CN)6]或高锰酸钾溶液,具体操作是取少量滤液1,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀,则证明有Fe2+或滴加KMnO4溶液,若褪色则证明有Fe2+;
(3)滤渣1为CuS和SiO2,SiO2不与稀硫酸、H2O2发生反应,CuS中S显-2价具有还原性,能被H2O2氧化,发生的离子方程式为CuS+H2O2+2H+![]() Cu2++S+2H2O;向盛有滤渣1的反应器中先加入稀硫酸,后滴入过氧化氢溶液,若顺序相反,会造成H2O2与固体颗粒接触分解;
Cu2++S+2H2O;向盛有滤渣1的反应器中先加入稀硫酸,后滴入过氧化氢溶液,若顺序相反,会造成H2O2与固体颗粒接触分解;
(4)获得晶体中含有结晶水,因此实验操作方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)根据锌原子守恒,Zn(OH)xCly的物质的量为![]() =0.1mol,Zn(OH)xCly的摩尔质量为
=0.1mol,Zn(OH)xCly的摩尔质量为![]() =106.4g/mol,则有65+17x+35.5y=106.4,根据化合价代数和为0,则有x+y=2,两式联立解得x=1.6,y=0.4,化学式为Zn(OH)1.6Cl0.4。
=106.4g/mol,则有65+17x+35.5y=106.4,根据化合价代数和为0,则有x+y=2,两式联立解得x=1.6,y=0.4,化学式为Zn(OH)1.6Cl0.4。