题目内容
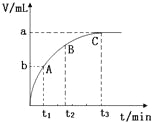
【题目】红磷和Cl2(g)反应的能量关系如图所示。下列叙述正确的是
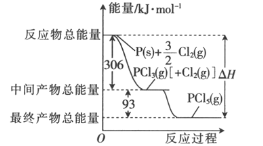
A.PCl5(g)比PCl3(g)稳定B.加入催化剂不会改变△H的大小
C.整个过程吸收的能量为399kJD.PCl3(g)的燃烧热△H=-93kJ·mol-1
【答案】B
【解析】
A.反应PCl3(g)+ Cl2(g)=PCl5(g)为放热反应,1molPCl3(g)和1mol Cl2(g)的总能量大于1molPCl5(g),但无法确定1molPCl3(g)和1molPCl5(g)的能量大小,无法确定二者的稳定性,选项A错误;
B. 加入催化剂只能改变反应的活化能,不会改变△H的大小,选项B正确;
C. 反应为可逆反应,整个过程反应物总能量大于生成物总能量,为放热,选项C错误;
D. 燃烧热是指1mol纯物质完全燃烧生成稳定氧化物所放出的热量,故不能由PCl3(g)+ Cl2(g)=PCl5(g) △H=-93kJ·mol-1得出PCl3(g)的燃烧热△H=-93kJ·mol-1,选项D错误;
答案选B。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
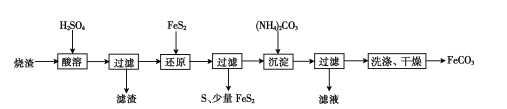
鹰派教辅衔接教材河北教育出版社系列答案【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、

试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式___。
(2)装置B的作用是①__,②___。
(3)若用A装置制取NO气体,B中应该盛放__。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为__。
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与__同时通入NaOH溶液中。
(6)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:__。(仅提供的试剂:1molL-1HCl、1molL-1HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20molL-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用___做指示剂。
物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为__。
【题目】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。
(2)反应①的化学平衡常数K表达式为________;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是________。
图1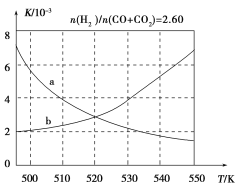
图2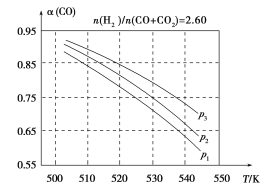
(3)合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是________________________________;图2中的压强由大到小为________,其判断理由是____________。
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行了探究。己知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是_______(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示);根据反应③判断△S_______(填“>”“=”或“<”)0,在_______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有______(填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g的浓度分别为 0.1mol/L、0.8 mol/L、0.3 mol/L、0.15 mol/L,则此时v(正)_______v(逆) (填“>”“=”或“<”)。
(5)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升高温度,t1时平衡,t2时减小压强,t3时增大CO的浓度,t4时又达到平衡。在下图中画出t2至t4的曲线。_____