题目内容
5.常温下,将0.05mol•L-1的盐酸溶液和未知浓度的氢氧化钠溶液以1:2的体积比混合,可得到混合液的pH为12,用上述氢氧化钠溶液滴定pH为3的某一元弱酸(HA)20mL,达到终点时消耗氢氧化钠溶液12.5mL.试求:(1)氢氧化钠溶液的物质的量浓度;
(2)此一元弱酸(HA)的物质的量浓度;
(3)此温度下一元弱酸(HA)的Ka.
分析 (1)混合后pH=12,说明混合后溶液中NaOH为0.01mol/L,设原氢氧化钠浓度为c,加入盐酸体积为1L,表示出剩余NaOH物质的量,再根据c=$\frac{n}{V}$计算;
(2)到达滴定终点时,弱酸与NaOH完全中和,HA与NaOH物质的量相等;
(3)根据HA溶液pH=3计算溶液中c(H+)、c(A-)、c(HA),代入Ka=$\frac{c({H}^{+})×c({A}^{-})}{c(HA)}$计算.
解答 解:(1)假设NaOH的浓度为amol/L,盐酸的体积为 1L,NaOH的体积为2L,混合后溶液的总体积为3L,又因为混合后溶液pH值为12,说明碱过量,混合后溶液中NaOH为0.01mol/L,则:$\frac{2L×c-0.05mol/L×1L}{3L}$=0.01mol/L,解得c=0.04mol/L,
答:氢氧化钠溶液的物质的量浓度为0.04mol/L;
(2)到达滴定终点时,与NaOH完全中和,HA与NaOH物质的量相等,则20mL×c(HA)=12.5mL×4×10-2mol/L,c(HA)=2.5×10-2mol/L,
答:一元弱酸的物质的量浓度为2.5×10-2mol/L;
(3)HA溶液pH=3,则溶液中c(H+)=c(A-)=0.001mol/L,c(HA)=0.025mol/L-0.001mol/L=0.024mol/L,故Ka=$\frac{c({H}^{+})×c({A}^{-})}{c(HA)}$=$\frac{0.001×0.001}{0.024}$≈4.17×10-5,
答:此温度下一元弱酸(HA)的Ka=4.17×10-5.
点评 本题是考查溶液pH有关计算、中和滴定计算、电离平衡常数计算等,难度不大,注意对基础知识的理解掌握.

| A. | 可用铝槽密闭盛装浓硫酸 | |
| B. | 工业上利用蛋白质的水解反应生产肥皂和甘油 | |
| C. | 乙醇可用作汽车燃料 | |
| D. | 食醋可用于消除暖水瓶中的水垢 |
| A. | 四氯化碳的电子式: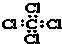 | B. | CH4分子的比例模型: | ||
| C. | 乙烯的球棍模型: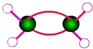 | D. | 乙炔的结构简式:CH≡CH |
| A. | 物质的量相等 | B. | 所含分子数相等 | ||
| C. | 质量相等 | D. | 所含碳原子数相等 |
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 反应物能量大于生成物能量的是放热反应 | |
| C. | 反应物能量大于生成物能量的是吸热反应 | |
| D. | 化学反应中也存在着反应物能量与生成物能量相等的反应情况 |
| A. | 使用催化剂能使化学反应速率加快,平衡常数增大 | |
| B. | 平衡常数随温度的改变而改变 | |
| C. | 化学平衡发生移动,平衡常数必发生变化 | |
| D. | 对于3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为K=$\frac{c(F{e}_{3}{O}_{4})•{c}^{4}({H}_{2})}{c(Fe)•{c}^{4}({H}_{2}O)}$ |