题目内容
现有铁粉与Fe2O3组成的混合物m g投入到足量的稀H2SO4中,在标准状况下收集到V L H2,所得溶液遇KSCN溶液不显红色,则混合物中Fe2O3的质量为
A.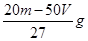 | B.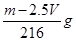 | C. | D.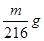 |
A
解析试题分析:由题意知有关反应为:①Fe2O3+ 3H2SO4= Fe2(SO4)3+ 3H2O ②Fe + Fe2(SO4)3= 3FeSO4;③Fe + H2SO4 = FeSO4 + H2 ↑, 所得溶液遇KSCN溶液不显红色,则溶液中没有Fe3+,所得溶液为FeSO4溶液。 在标准状况下收集到VL H2,其物质的量是V/22.4mol,由反应③知与稀硫酸反应的铁为V/22.4mol质量为2.5Vg。由反应①、②知其余的铁与Fe2O3的物质的量之比是1:1。设Fe2O3、Fe的物质的量为x 160x+56x=m—2.5V解得x=(m—2.5V)/216(mol),Fe2O3的质量为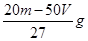
考点:考查铁及其化合物的性质,关系式法计算。

将2.3g钠放入足量的质量为m g的水中,另将0.1mol镁放入足量的质量为m g的稀硫酸中,反应结束后得两溶液的质量分别为a g和b g ,则a g与b g两数的关系应是
| A.a>b | B.a=b | C.a<b | D.无法确定 |
已知等体积的20%硫酸溶液其质量大于10%硫酸溶液,则将溶质的质量分数为a%、物质的量浓度为C1 mol·L-1的稀硫酸加热蒸发掉溶液总质量的一半的水,此时溶质的质量分数变为b%,物质的量浓度为C2 mol·L-1,下列关系正确的是
| A.b﹤2 a | B.C2﹤2 C1 | C.C2﹥2 C1 | D.C1="2" C2 |
设NA为阿伏加德罗常数的数值,下列叙述正确的是
A.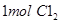 与足量Fe反应转移电子数一定为3NA 与足量Fe反应转移电子数一定为3NA |
| B.标准状况下,22.4L NH3中含有共价键的数目为NA |
C.1.0L 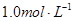 的 的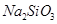 水溶液中含有的氧原子数为3NA 水溶液中含有的氧原子数为3NA |
D.4.6g Na完全转化成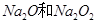 的混合物,混合物中阴离子总数为0.1NA 的混合物,混合物中阴离子总数为0.1NA |
下列化学用语的理解正确的是
A.离子结构示意图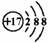 :可以表示35Cl-,也可以表示37Cl- :可以表示35Cl-,也可以表示37Cl- |
B.电子式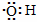 :可以表示羟基,也可以表示氢氧根离子 :可以表示羟基,也可以表示氢氧根离子 |
C.比例模型 :可以表示甲烷分子,也可以表示四氯化碳分子 :可以表示甲烷分子,也可以表示四氯化碳分子 |
D.聚丙烯的结构简式: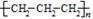 |
用NA表示阿伏加德罗常数的值。下列判断错误的是( )
| A.NA个H+的质量为1 g |
| B.2 L 0.5mol/LNa2SO4溶液中含NA个Na+ |
| C.32 g O2中含有2NA个O原子 |
| D.标准状况下,1 mol H2O中含有NA个分子 |
足量铜粉与一定量的浓硝酸充分反应,得到硝酸铜溶液和 NO2、N2O4、NO 的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好沉淀完全,则消耗 NaOH溶液的体积是( )
| A.60 mL | B.45 mL | C.30 mL | D.15 mL |
下列各溶液中,c( Na+ ) 最大的是( )
| A.4L 0.5mol/L的NaCl溶液 | B.2L 0.8mol/L的NaOH溶液 |
| C.1L 1mol/L的Na2CO3溶液 | D.0.5L 1.2mol/L的Na2SO4溶液 |
在标准状况下有:①6.72 L CH4;②3.01×1023个氯化氢分子;③13.6 g硫化氢;④0.2 mol氨气。四种气体中含有的氢原子数大小顺序为
| A.①>③>④>② | B.②>③>④>① |
| C.①>④>②>③ | D.②>③>①>④ |