题目内容
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)> c(OH-)>c(H+) |
| B.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3) |
| C.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c( Cl-) |
| D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
AB
解析试题分析:A项中,pH=2的盐酸c(H+)大小与pH=12的氨水的c(OH-)相等,所以二者等体积混合,氨水过量,溶液显碱性,所以混合后离子浓度大小有c(NH4+)>c(Cl-)> c(OH-)>c(H+),A正确;0.1 mol·L-1 Na2CO3溶液有物料守恒式c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3),所以B正确;0.1 mol·L-1 NH4Cl溶液中,NH4+ 水解呈酸性,所以c(H+)>c(OH-),c(NH4+)<c( Cl-),C错误;醋酸钠溶液中加入适量醋酸后显酸性,则c(H+)>c(OH-),又电荷守恒式有c(Na+)+ c(H+) = c(CH3COO-)+c(OH-),所以c(Na+)<c(CH3COO-),所以D错误;故选AB。
考点:本题考查的是混合溶液中离子浓度大小比较。

硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等。某温度时,HgS在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
| A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小 |
| B.图中a点对应的是饱和溶液 |
| C.向c点的溶液中加入Hg(NO3)2,则c(S2-)减小 |
| D.升高温度可以实现c点到b点的转化 |
常温下,用 0.1000 mol·L NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L
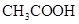 溶液所得滴定曲线如右图。下列说法正确的是
溶液所得滴定曲线如右图。下列说法正确的是
A.点①所示溶液中: |
B.点②所示溶液中: |
C.点③所示溶液中: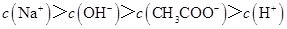 |
D.滴定过程中可能出现: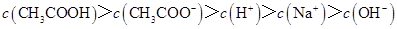 |
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
下列说法正确的是
A.CN- + H2O + CO2 =" HCN" + HCO3-
B.0.1mol·L-1HCOONa溶液比0.1mol·L-1NaCN溶液的pH大
C.用0.1mol·L-1NaOH溶液中和等浓度的HCN和HCOOH时前者所需NaOH溶液体积大
D.0.1mol·L-1NaHCO3溶液中粒子浓度的大小:c(Na+)> c(HCO3-)>c(H+)>c(OH-)
已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4(s)=2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如右图所示,则下列说法错误的是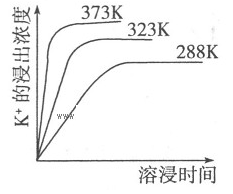
| A.向该体系中加入饱和NaOH溶液,溶解平衡向右移动 |
| B.向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动 |
| C.该平衡的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO42-) |
| D.升高温度,反应速率增大,平衡向正反应方向移动 |
某温度下,CO2饱和溶液的浓度是0.03mol/L,其中1/3的CO2转变为H2CO3,而H2CO3仅有0.1%发生如下电离:H2CO3 H++HCO3—,则溶液的pH约为( )
H++HCO3—,则溶液的pH约为( )
| A.3 | B.4 | C.5 | D.6 |
下列叙述正确的是 ( )
| A.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 |
| B.将氢氧化钠溶液和氨水各稀释一倍,两者的c(OH-)均减少到原来的一半 |
| C.常温下,某溶液中由水电离出的c(OH-)=1×10-10mol/L,该溶液可能是盐酸 |
| D.如果盐酸的物质的量浓度是醋酸的两倍,则盐酸的c(H+)也是醋酸的两倍 |
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是( )
| A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH-)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |