题目内容
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是
①pH=l的强酸溶液加水稀释后,溶液中各离子浓度一定减小
②pH=2的盐酸和pH=l的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3 COONa、b.C6H5 ONa、c.NaHCO3、d.NaOH,其溶液物质的量浓度由小到大的顺序为d<b<c<a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质溶液,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
| A.③⑤⑥ | B.③④⑥ | C.④⑤⑥ | D.①②④ |
A
解析试题分析:①强酸溶液全部电离,加水稀释后,溶液中H+离子浓度一定都降低但氢氧根离子浓度增大,故①错误;pH=2的盐酸和pH=1的盐酸,c(H+)之比为1:10,故②错误;四种盐的水溶液均显碱性,同浓度,碱性强弱顺序为d>b>c>a,故pH相等的四种溶液物质的量浓度由小到大顺序为d、b、c、a,故③正确;④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,溶液中存在c(H+)+c(Na+)=2c(SO42-),则c(Na+)<2c(SO42-),故④错误;⑤水解和电离为可逆过程, ,
, ;则有Ka·Kh=Kw,故⑤正确;⑥当pH之和等于14时,则混合液pH=7,故⑥正确。综合以上分析,符合题意有③⑤⑥,所以选A。
;则有Ka·Kh=Kw,故⑤正确;⑥当pH之和等于14时,则混合液pH=7,故⑥正确。综合以上分析,符合题意有③⑤⑥,所以选A。
考点:考查弱电解质的电离、pH的计算、盐类的水解以及酸碱混合的定性判断和计算。

下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)> c(OH-)>c(H+) |
| B.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3) |
| C.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c( Cl-) |
| D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
下列溶液中微粒的物质的量浓度关系正确的是
| A.25℃时,pH=7的NH4Cl与NH3?H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) |
| B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.25℃时,pH=2的CH3COOH与pH=12的NaOH等体积混合: c(CH3COO-)+c(H+)<c(Na+)+c(OH-) |
| D.0.1mol/LNa2CO3溶液:2c(CO32-)+2c(HCO-)+2c(H2CO3)=c(Na+) |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S: Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是
| A.CuS<Cu(OH)2<CuCO3 | B.CuCO3<Cu(OH)2<CuS |
| C.CuS<CuCO3<Cu(OH)2 | D.Cu(OH)2<CuCO3<CuS |
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是( )
| A.若a=b,则c(NH4+)=c(Cl-) |
| B.若a>b,则c(NH4+)>c(Cl-) |
| C.若a>b,则c(OH-)>c(H+) |
| D.若a<b,则c(OH-)<c(H+) |
下列各溶液中,微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC )+c(H+)>c(C )+c(H+)>c(C ) ) |
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S )>c(N )>c(N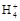 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC )>c(H+) )>c(H+) |
| D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) |
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是( )
| A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH-)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是( )
| A.AlCl3 | B.Na2SO3 | C.KMnO4 | D.MgSO4 |

