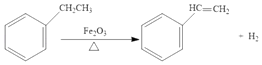
题目内容
【题目】某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案.回答下列问题:
(1)沉淀A的化学式是 , 滤液B中的含铝元素的化合物化学式是 .
(2)写出步骤②中发生的两个主要反应,用离子方程式表示为: , .
(3)步骤③中发生的主要离子方程式为 . 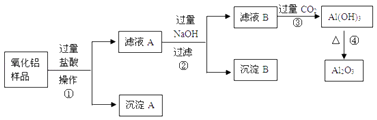
【答案】
(1)SiO2; NaAlO2
(2)Fe+2H+=Fe2++H2↑; Fe+2Fe3+=3Fe2+
(3)AlO2﹣+CO2+H2O═Al(OH)3↓+HCO3﹣
【解析】解:(1)由上述分析可知,沉淀A为SiO2,滤液B中的阴离子除了Cl﹣、OH﹣外还有AlO2﹣,含铝元素的化合物化学式是NaAlO2,所以答案是:SiO2;NaAlO2;(2)滤液A中若加入过量的铁粉,②中可能发生的所有离子方程式为Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+,所以答案是:Fe+2H+=Fe2++H2↑;Fe+2Fe3+=3Fe2+;(3)③的离子反应方程式为AlO2﹣+CO2+H2O═Al(OH)3↓+HCO3﹣,所以答案是:AlO2﹣+CO2+H2O═Al(OH)3↓+HCO3﹣.

练习册系列答案
相关题目