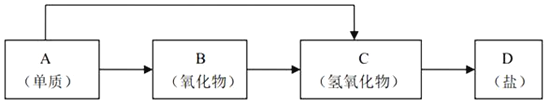
题目内容
【题目】按要求填空:
(1)48gCH4其摩尔质量为___________________,含有______________mol电子,在标准状况下所占体积约为____________L。
(2)等物质的量浓度的Ca(OH)2溶液与NaHCO3溶液按体积比1:2混合,混合之后的溶液发生反应的离子方程式为:____________________________________________________________。
(3)制备氢氧化铁胶体的离子方程式:____________________________________。
(4)写出H++HCO3-=H2O+CO2↑对应的一个化学方程式:____________________________________。
【答案】16g/mol 30 67.2 Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+ HCl+NaHCO3=H2O+CO2↑+NaCl
Fe(OH)3(胶体)+3H+ HCl+NaHCO3=H2O+CO2↑+NaCl
【解析】
(1)CH4的摩尔质量为16g/mol,48gCH4含有![]() 电子,在标准状况下所占体积约为
电子,在标准状况下所占体积约为![]() ×22.4L/mol=67.2L;
×22.4L/mol=67.2L;
正确答案:16g/mol;30;67.2。
(2)等物质的量浓度的Ca(OH)2溶液与NaHCO3溶液按体积比1:2混合,也就是按物质的量之比1:2混合,混合之后的溶液发生反应的离子方程式为Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-;
正确答案:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-。
(3)向沸腾的蒸馏水中逐滴加入1~2mL饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热,制备氢氧化铁胶体,所以离子方程式为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;
Fe(OH)3(胶体)+3H+;
正确答案:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。
(4)H++HCO3-=H2O+CO2↑对应的一个化学方程式,应该选择强酸与易溶于水的碳酸氢盐,所以化学方程式为HCl+NaHCO3=NaCl+CO2↑+H2O;
正确答案:HCl+NaHCO3=NaCl+CO2↑+H2O。

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O 是一种光敏材料,见光易分解,下面是一种制备草酸合铁酸钾晶体的实验流程。
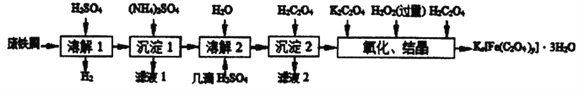
已知:(NH4)SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | — |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,得用在5%Na2CO3溶液中加热数分钟,并洗涤干净.Na2CO3溶液的作用是___________________。
(2)“复分解”制备莫尔盐晶体的基本实验步骤是: 蒸发浓缩、_________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是_________ 。
(3)“沉淀2"时得到的FeC2O4·2H2O 沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是_____。
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是_________ 。
(5)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤1: 准确称量5.00g 草酸合铁酸钾晶体,配制成250mL 溶液
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/L KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.重复步骤2、步骤3 操作,滴定消耗 0.010mol/LKMnO4溶液19.98mL,实验测得该晶体中铁的质量分数为_____ (写出计算过程)。